Carbonato de sódio (Na2CO3)
- 2630
- 453
- Lonnie MacGyver
Explicamos o que o carbonato de sódio, suas propriedades físicas e químicas, estrutura e aplicações são
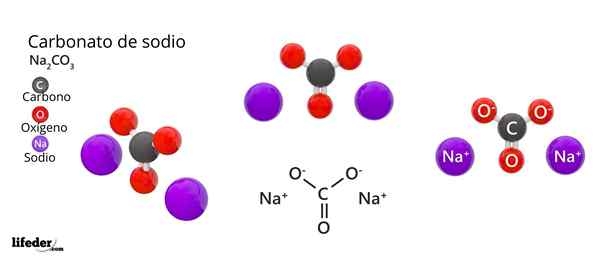
 Estrutura e fórmula de carbonato de sódio
Estrutura e fórmula de carbonato de sódio O que é carbonato de sódio?
Ele carbonato de sódio (N / D2Co3) É um sal inorgânico, metal alcalino e ácido carbônico. Ele também é conhecido em todo o mundo como Sosa Ash. Lagos e atividades vulcânicas enriqueceram os solos de sódio, dos quais as plantas foram nutridas; Depois de um incêndio, essas plantas espalham as cinzas carbonáticas.
Como esse sal metálico de sódio surge? O sódio puro tem uma configuração de Valência [NE] 3s1. O elétron orbital 3S1 É facilmente desapegado por outros elementos da natureza (como enxofre, oxigênio, cloro, fluorina, etc.), formando compostos minerais onde o íon estável na participação+.
Então uma+ É acompanhado por outras espécies iônicas nesses sólidos; Destes, o carbonato de sódio é apenas mais um presente na natureza. Desde então, ele usou em todas as civilizações ao longo dos tempos. Essas civilizações estavam descobrindo que as propriedades benéficas de poeira cinza para suas casas e pessoas.
Essas propriedades marcaram seus usos, que hoje mantêm aspectos tradicionais do passado, e outros acomodam as necessidades atuais.
O carbonato de sódio é de natureza muito abundante, e talvez também em outros territórios fora do planeta Terra, como algumas das luas do sistema solar.
Fórmula
A fórmula química de carbonato de sódio é Na2Co3. Como é interpretado? Isso significa que, no sólido cristalino, para cada co -ion32- Existem dois íons Na+.
Estrutura de carbonato de sódio
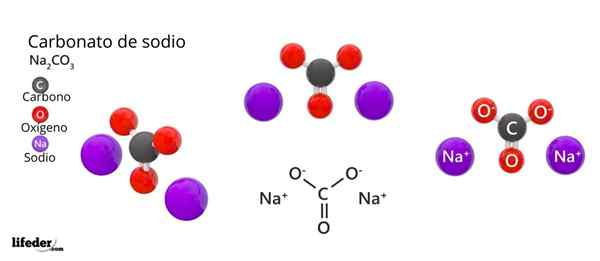
Na imagem superior, a estrutura do NA é representada2Co3 Anidrido (também chamado Sosa Calcinada). Esferas roxas correspondem a íons Na+, Enquanto preto e vermelho para os íons Co32-.
Os íons carbonatos têm uma estrutura trigonal plana, com átomos de oxigênio em seus vértices.
Pode atendê -lo: ácido cinâmico: estrutura, propriedades, obtenção, usoA imagem fornece um panorama visto de um avião superior. Íons Na+ Eles estão cercados por seis átomos de oxigênio, de co -onons32-. Isto é, no NA2Co3 Anidrido O sódio encontra uma geometria de coordenação octaédrica (está trancada no centro de um octaedro).
No entanto, essa estrutura também é capaz de abrigar moléculas de água, interagindo com pontes de hidrogênio com os vértices dos triângulos.
De fato, NA hidrata2Co3 (N / D2Co3· 10h2Ou, na2Co3· 7h2Ou, na2Co3· H2Ou, e outros) são de maior abundância do que o sal de anidro.
O Thermonatrite (NA2Co3· H2O), o natron (NA2Co3· 10h2O) e o trona (na3(HCO3) (Co3) · 2h2Ou são as principais fontes naturais de carbonato de sódio, especialmente o mineral de Trona, representado na primeira imagem.
Usos/aplicações de carbonato de sódio
O carbonato de sódio cumpre inúmeras funções em pessoas, famílias e indústria, entre essas funções, o seguinte se destaca:
- O carbonato de sódio é usado em numerosos produtos de limpeza. Isso se deve à sua capacidade desinfetante, seu poder de dissolver gorduras e suas propriedades para suavizar a água. Faz parte dos detergentes usados em lavanderias, lava -louças automáticas, vidro limpo, manchas mexendo, arquibancadas etc.
- O desinfetante de carbonato pode ser usado em superfícies duras não respostas, como pisos, paredes, porcelana e banheiras, com exceção do Fibra de vidro e alumínio, que pode ser arranhado por ele.
- É usado em alguns alimentos para evitar o coparia que pode ocorrer nestes.
- Está presente em vários produtos de cuidados pessoais, como banhos de espuma, massas dentárias e sabonetes.
- É usado na indústria de vidro devido à sua capacidade de quebrar silicatos.
- É usado na manutenção das piscinas, onde cumpre uma função desinfetante e reguladora do pH.
- Em humanos usados terapeuticamente no tratamento da acidez e dermatite.
- Na medicina veterinária, é usado no tratamento de micose e limpeza da pele.
Síntese de carbonato de sódio

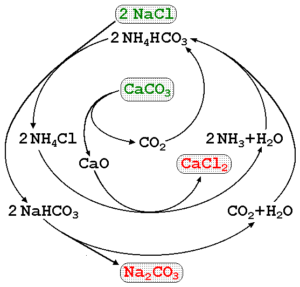
O carbonato de sódio pode ser fabricado usando salmoura do mar e calcário (caco3) No processo Solvay. Na imagem superior, um diagrama de processo é ilustrado apontando as rotas de produção, bem como os reagentes, intermediários e produtos. Os reagentes são escritos com letras verdes e os produtos com letras vermelhas.
O monitoramento dessas reações pode ser um pouco complexo, mas a equação global que indica apenas os reagentes e produtos é:
2NACL (aq) + caco3(S) NA2Co3(s) + cacl2(AC)
O caco3 Ele tem uma estrutura cristalina muito estável, por isso exige constantemente muita energia para decompõe -a em CO2. Além disso, esse processo gera grandes quantidades de CACL2 (cloreto de cálcio) e outras impurezas, cujas descargas afetam a qualidade da água e o meio ambiente.
Existem também outros métodos de produção de carbonato de sódio em campos industriais, como processos HOU e LeBlanc.
Hoje é a obtenção de seus minerais naturais é sustentável, sendo o Trona o mais abundante deles.
Por outro lado, o método mais tradicional consistia no cultivo e queima de plantas e algas ricas em sódio. Então, as cinzas foram banhadas com água e submetidas a aquecimento até o produto. Daqui emergiu as famosas cinzas de Sosa.
Propriedades de carbonato de sódio
Então uma2Co3 É um sólido branco higroscópico, vaso sanitário, com um peso molecular de 106 g/mol e uma densidade de 2,54 g/ml a 25 ° C.
Suas propriedades mudam como uma molécula de água incorpora em sua estrutura cristalina. Como a água pode formar pontes de hidrogênio e os íons "espaço aberto" entre elas, o volume do vidro aumenta e a densidade do hidrato diminui. Por exemplo, para NA2Co3· 10h2Ou, sua densidade é de 1,46 g/ml.
Pode servir a você: reação reversível: características e exemplosEntão uma2Co3 derrete a 851 ºC, decompondo de acordo com a seguinte equação:
N / D2Co3(s) => Na2Ou (s) + CO2(g)
Novamente, apesar dos co -íons32- e na+ Eles diferem nos tamanhos, suas interações eletrostáticas são muito eficientes e mantêm uma rede cristalina estável.
As moléculas de água "impedem" essas interações e, como resultado, os hidratos são mais suscetíveis a decompor do que o anidrido.
É um sal básico; isto é, dissolvido na água, gera uma solução com um pH maior que 7. Isto é devido à hidrólise de CO32-, cuja reação libera oh- No meio:
Co32-(AC) + H2Ou (l) HCO3-(AC) + OH-(AC)
É muito solúvel em solventes de água e polares, como glicerol, glicerina, acetona, acetatos e amônia líquida.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. Nos elementos do grupo 1. (Quarta edição., p. 265). Mc Graw Hill.
- Scifun.org. (2018). Carbonato de hidrogênio de sódio e carbonato de sódio. Recuperado de Scifun.org
- Wikipedia. (2018). Carbonato de Sódio. Recuperado de.Wikipedia.org
- PubChem. (2018). Carbonato de Sódio. Recuperado de PubChem.NCBI.Nlm.NIH.Gov
- Ciner Resources Corporation. (2018). Refrigerante. Ciner se recuperou.nós.com
- Peltier k. (3 de julho de 2018). Tudo o que você precisa saber sobre o sódio carbonite. Recuperado em 8 de abril de 2018, de: Thesprúce.com
- Net Industries. (2018). Carbonato de sódio - Usos de carbonato de sódio. Recuperado em 8 de abril de 2018, de: ciência.Jank.org

