Conceito e fórmula de volume molar, cálculo e exemplos
- 949
- 170
- Conrad Schmidt
Ele volume molar É uma propriedade intensiva que indica quanto espaço um mol de uma determinação ou composto ocupa. É representado pelo símbolo Vm, e é expresso em unidades de DM3/mol para gases e cm3/mol para líquidos e sólidos, porque os últimos estão mais confinados por suas maiores forças intermoleculares.
Essa propriedade é recorrente ao estudar sistemas termodinâmicos que envolvem gases; Como, para líquidos e sólidos, as equações para determinar vm Eles se tornam mais complicados e imprecisos. Portanto, no que diz respeito aos cursos básicos, o volume molar está sempre associado à teoria dos gases ideais.
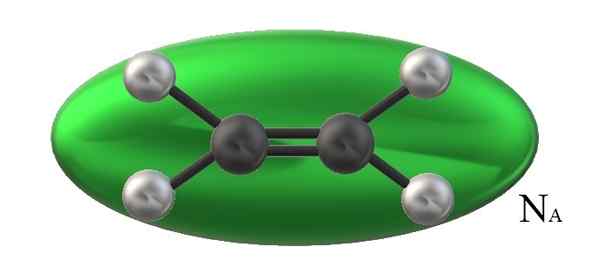
 O volume de uma molécula de etileno é superficialmente limitada pelo elipsóide verde e o número de Avogadro vezes esse valor. Fonte: Gabriel Bolívar.
O volume de uma molécula de etileno é superficialmente limitada pelo elipsóide verde e o número de Avogadro vezes esse valor. Fonte: Gabriel Bolívar. Isso ocorre porque, para os gases ideais ou perfeitos, os aspectos estruturais são irrelevantes; Todas as suas partículas são visualizadas como esferas que colidem elasticamente entre si e se comportam da mesma maneira, independentemente do que suas massas ou propriedades são.
Assim, uma mole de qualquer gás ideal ocupará, a certa pressão e temperatura, o mesmo volume Vm. Dizem que em condições normais de P e T, 1 atm e 0 ºC, respectivamente, uma toupeira de um gás ideal ocupará um volume de 22,4 litros. Este valor é útil e aproximado, mesmo quando os gases reais são avaliados.
[TOC]
Conceito e fórmula
Para gases
A fórmula imediata para calcular o volume molar de uma espécie é:
Vm = V/n
Onde v é o volume que ocupa, e n A quantidade de espécies em toupeiras. O problema é que Vm Depende da pressão e temperatura experimentadas pelas moléculas, e uma expressão matemática é desejada para levar em consideração essas variáveis.
Pode atendê -lo: molalidadeO etileno da imagem, h2C = ch2, Possui um volume molecular associado e limitado por um elipsóide verde. Isso h2C = ch2 Ele pode girar de várias maneiras, que é como se se movesse no espaço, disse Ellipsoid para visualizar quanto volume ocuparia (evidentemente desprezível).
No entanto, se o volume desse elipsóide verde, multiplicarmos por nPARA, O número Avogadro terá uma toupeira de moléculas de etileno; um mol de elipsóide interagindo entre si. A uma temperatura mais alta, as moléculas se separam uma da outra; Enquanto estava em maior pressão, eles contratarão e reduzirão seu volume.
Portanto, vm depende de P e T. O etileno é geometria plana, por isso não se pode pensar que é vm Ser preciso e exatamente o mesmo que o de metano, Cho4, de geometria tetraédrica e capaz de ser representada com uma esfera e não um elipsóide.
Para líquidos e sólidos
As moléculas ou átomos de líquidos e sólidos também têm seu próprio Vm, que pode estar relacionado à sua densidade:
Vm = m/(d · n)
A temperatura afeta o volume molar mais para líquidos e sólidos do que a pressão, desde que este não varie acentuadamente ou exorbitante (na ordem do GPA). Da mesma forma, como foi mencionado com etileno, geometrias e estruturas moleculares têm uma grande influência nos valores de Vm.
No entanto, em condições normais, observa -se que densidades para diferentes líquidos ou sólidos não variam muito em suas magnitudes; O mesmo vale para seus volumes molares. Observe que quanto mais densos forem, o VIm.
Em relação aos sólidos, seu volume molar também depende de suas estruturas cristalinas (o volume de sua célula unitária).
Pode servir a você: biftalato de potássio: estrutura, nomenclatura, usos, riscosComo calcular o volume molar?
Ao contrário de líquidos e sólidos, para gases ideais, há uma equação que permite calcular Vm dependendo de P e T e de suas mudanças; Isto é, o dos gases ideais:
P = NRT/V
Que é confortável para expressar v/n:
V/n = rt/p
Vm = RT/P
Se usarmos a constante de gás r = 0,082 l · atm · k-1· Mol-1, Então as temperaturas devem ser expressas em Kelvin (K) e as pressões nas atmosferas. Observe que é observado aqui por que vm É uma propriedade intensiva: T e P não têm nada a ver com a massa do gás, mas com seu volume.
Esses cálculos são válidos apenas em condições em que os gases se comportam de perto com a idealidade. No entanto, os valores obtidos através da experimentação têm uma pequena margem em relação aos teóricos.
Exemplos de cálculo de volume molar
Exemplo 1
Você tem um gás e cuja densidade é 8,5,10-4 g/cm3. Se você tem 16 gramas equivalente a 0,92 moles de y, calcule seu volume molar.
A partir da fórmula de densidade, podemos calcular de que volume e ocupar esses 16 gramas:
V = 16 g/ (8,5,10-4 g/cm3)
= 18.823,52 cm3 ou 18,82 l
Então vm É calculado diretamente dividindo este volume entre a quantidade de toupeiras dadas:
Vm = 18,82 l/0,92 mol
= 20,45 l/mol o l · mol-1 ou dm3· Mol-1
Exercício 2
No exemplo anterior de e não foi especificado a qualquer momento qual era a temperatura experimentada pelas partículas do referido gás. Supondo que funcionasse com e à pressão atmosférica, calcule a temperatura necessária para comprimi -la no volume molar determinado.
Pode atendê -lo: fator de embalagemA declaração de exercício é mais longa que sua resolução. Nós nos voltamos para a equação:
Vm = RT/P
Mas limpamos o T, e sabendo que a pressão atmosférica é de 1 atm, resolvemos:
T = vmP/r
= (20,45 l/mol) (1 atm)/(0,082 l · atm/k · mol)
= 249,39 k
Isto é, uma toupeira e ocupará 20,45 litros a uma temperatura próxima a -23,76 ºC.
Exercício 3
Seguindo os resultados acima, determine Vm a 0 ºC, 25 ° C e a zero absoluto à pressão atmosférica.
Transformando as temperaturas em Kelvin, temos os primeiros 273,17 K, 298,15 K e 0 K. Resolvemos diretamente substituindo a primeira e a segunda temperaturas:
Vm = RT/P
= (0,082 L · atm/ k · mol) (273,15 k)/ 1 atm
= 22,40 L/mol (0 ºC)
= (0,082 L · atm/ k · mol) (298,15 k)/ 1 atm
= 24,45 L/mol (25ºC)
O valor de 22,4 litros foi mencionado no começo. Observe como vm aumentar com a temperatura. Quando você deseja fazer o mesmo cálculo com zero absoluto, tropeçamos na terceira lei da termodinâmica:
(0,082 L · atm/ k · mol) (0 k)/ 1 atm
= 0 L/mol (-273,15 ºC)
O gás e não pode ter um volume molar não existente; Isso significa que se tornou um líquido e a equação anterior não é mais válida.
Por outro lado, a impossibilidade de calcular vm Em absoluto zero obedece à terceira lei da termodinâmica, que diz que é impossível resfriar qualquer substância à temperatura do zero absoluto.
Referências
- Irã. Levine. (2014). Princípios da físico -química. Sexta edição. Mc Graw Hill.
- Glasstone. (1970). Tratado de Química Física. Segunda edição. Aguilar.
- Wikipedia. (2019). Volume molar. Recuperado de: em.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (8 de agosto de 2019). Definição de volume molar em química. Recuperado de: pensamento.com
- Byju's. (2019). Fórmula de volume molar. Recuperado de: byjus.com
- González Mónica. (28 de outubro de 2010). Volume molar. Recuperado de: química.LaGuia2000.com

