Peças e exemplos da equação química
- 1022
- 198
- Mr. Reginald Lindgren
O Equação química É uma representação esquemática de algumas das características de uma reação química. Pode -se dizer também que a equação química descreve as mudanças experimentadas pelas diferentes substâncias envolvidas em uma reação.
Na equação química, são colocadas as fórmulas e símbolos das diferentes substâncias participantes, apontando claramente o número de átomos de cada elemento presente nos compostos, que aparece como um subscrito e não pode ser alterado ao equilibrar a equação.
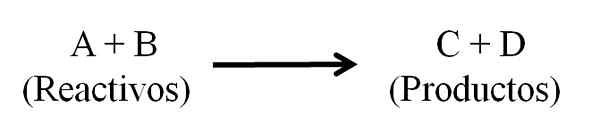
 Equação química geral para uma reação química. Reagentes e produtos. Fonte: Gabriel Bolívar.
Equação química geral para uma reação química. Reagentes e produtos. Fonte: Gabriel Bolívar. A equação química deve parecer equilibrada, ou seja, o número de átomos de reagentes e produtos deve ser o mesmo. Dessa maneira, a lei da conservação da matéria é obedecida. É desejável que os números usados para equilibrar as equações sejam números inteiros.
Essas equações não revelam etapas consecutivas ou por que os reagentes de mecanismos são transformados em produtos.
É por isso que, embora sejam muito úteis para entender para onde está indo uma reação química, ela não permite entender seus aspectos moleculares ou como eles são afetados por certas variáveis; como pH, viscosidade, tempo de reação, velocidade de agitação, entre outros.
[TOC]
Partes de uma equação química
Basicamente, existem três partes principais em uma equação química: os reagentes, os produtos e a flecha que indica o significado da reação química.
Localização de reagentes e produtos
Na equação química, todas as substâncias que funcionam como reagentes e todos aqueles que são produtos aparecem. Esses grupos de substâncias são separados por uma seta que indica o significado da reação. Os reagentes estão localizados à esquerda da flecha e os produtos à direita.
A seta significa o que é produzido e orientado da esquerda para a direita (→), embora nas reações reversíveis haja duas setas equivalentes e paralelas; um dirigido para a direita e outro para a esquerda. O símbolo (δ) é geralmente colocado na seta, indicando que o calor era usado na reação.
Pode atendê -lo: TerpenosAlém disso, a identificação do catalisador é geralmente colocada na flecha, se possível com sua fórmula ou símbolo. As diferentes substâncias que aparecem como reagentes são separadas pelo sinal (+), indicando que as substâncias reagem ou se combinam.
No caso de substâncias que aparecem como produtos, o sinal (+) não possui a conotação anterior; a menos que a reação seja reversível. É conveniente que o sinal (+) seja colocado equidistante das substâncias que separam.
Equilíbrio de equações químicas
É um requisito essencial de que as equações químicas sejam adequadamente equilibradas. Para isso, um número chamado coeficiente estequiométrico é colocado. Sempre que necessário, esse coeficiente deve ficar na frente das substâncias que aparecem como reagentes ou produtos.
Isso é assim para garantir que o número de todos os átomos dos elementos que aparecem como reagentes seja exatamente igual ao número deles que aparece no produto. O método de equações químicas mais simples é o de Tanteo.
Estados físicos dos componentes da equação química
Em algumas equações químicas, o estado físico das substâncias é indicado com uma subndemry. Para isso, as seguintes abreviações são usadas em espanhol: (s) para o estado sólido; (l) para o estado líquido; (g), estado gasoso; e (AC), solução aquosa.
Exemplo: reação de carbonato de cálcio com ácido clorídrico.
Ladrão3 (s) + 2 hcl(AC) → CaCl2 (s) + H2QUALQUER(EU) + Co2 g)
Mudanças de status físico
Em alguns casos, é indicado na equação química se houver uma produção de um gás na reação química ou se houver a precipitação de alguma das substâncias produzidas.
Pode atendê -lo: sais bináriosA presença de um gás é indicada com uma seta vertical com a extremidade direcionada para cima (↑), colocada no lado direito da substância gasosa.
Exemplo: reação de zinco com ácido clorídrico.
Zn +2 HCl → ZnCl2 + H2↑
Se na reação química, uma das substâncias forma um precipitado, isso é simbolizado colocando uma seta vertical com a extremidade direcionada para baixo (↓), colocada no lado direito da substância precipitada.
Exemplo: reação do ácido clorídrico com nitrato de prata.
Hcl + Agno3 → hno3 + AGCL ↓
Exemplo de equações químicas
- Fotossíntese
 Equação de fotossíntese
Equação de fotossíntese A fotossíntese é um processo pelo qual as plantas capturam e transformam energia luminosa, da luz solar, para gerar a energia necessária para sua subsistência. A fotossíntese é realizada por organelas típicas de células vegetais chamadas cloroplastas.
Na membrana cloroplasta são tilacóides, lugares onde as clorofilas são encontradas para e b, que são os principais pigmentos que capturam energia luminosa.
Embora a fotossíntese seja um processo complexo, ela pode ser esquematizada na seguinte equação química:
6 co2 + 6 h2O → c6H12QUALQUER6 + 6 o2↑ Δgº = 2.870 kJ/mol
C6H12QUALQUER6 É a fórmula de glicose, carboidrato metabolizado para a produção de ATP; Composto que é o principal reservatório de energia na maioria dos seres vivos. Além disso, da glicose Nadph é gerada, a coenzima necessária para inúmeras reações.
- Respiração celular
As células usam oxigênio para o metabolismo de numerosas substâncias presentes em alimentos ingeridos. Enquanto isso, o ATP é usado como fonte de energia das atividades realizadas por seres vivos, produzindo nesses processos carbono e água de dióxido.
Pode servir a você: acetato de alumínio (AL (CH3COO) 3): estrutura, propriedades, usosSe a glicose for usada como modelo de substância metabolizada, a respiração pode ser esquematizada pela seguinte equação química:
C6H12QUALQUER6 + 6 o2 → 6 co2 + 6 h2QUALQUER
- Reações comuns de elementos
Reação de decomposição
Um composto ou compostos se dissocia (n) formando com seus átomos outros compostos diferentes:
2 KCLO3 (s) → 2 kcl(S) + 3 o2 g)
Reação de deslocamento
Um metal reage com um composto substituindo um metal presente neste:
Mg(S) + CUSO4 (CA) → Cu(S) + Mgso4 (CA)
Reação de eliminação
Nesse tipo de reação, o número de átomos ou grupos ligados a um átomo de carbono:
CH3-CH2BR +NAOH → H2C = ch2 + H2O +nabr
Reação de hidratação
É uma reação em que um composto adiciona uma molécula de água. Esta reação é importante na preparação de álcoois:
H2C = ch2 + H2O → h2C-CH2Oh
Reação neutralizadora
Uma base ou álcali reage com um ácido produzindo sal e água:
Hcl(AC) + Naoh(AC) → NaCl(AC) + H2QUALQUER(EU)
Reação de síntese
Nesse tipo de reação, duas ou mais substâncias são combinadas para causar um novo composto:
2 Li(S) + Cl2 g) → 2 LiCl(S)
Reação de deslocamento duplo (metátese)
Nesse tipo de reação, há troca de íons positivos e negativos para formar novos compostos:
Agno3 (CA) + NaCl(AC) → Agcl(S) + Irmão mais velho3 (CA)
Referências
- Flores, j. (2002). Química. Edição 1era. Santillana Editorial
- Mathews, c. K., Van holde, k. E., E Ahern, k. G. (2002). Bioquímica. 3era Edição. Pearson Addison Wesley Editorial
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Wikipedia. (2019). Equação química. Recuperado de: em.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (20 de setembro de 2019). O que é uma equação química? Recuperado de: pensamento.com
- « Conceito e fórmula de volume molar, cálculo e exemplos
- Challenger Abyss Formação geológica, localização, características »

