Grupo metil ou metil

- 3665
- 406
- Ralph Kohler
Ele Grupo metil ou metil É um substituinte alquílico cuja fórmula química é Cho3. É o mais simples de todos os substituintes carbonatados na química orgânica, possui um único carbono e três hidrogênios; deriva de gás metano. Como só pode ser ligado a outro carbono, sua posição indica o fim de uma cadeia, sua terminação.
Na imagem abaixo, você tem uma das muitas representações deste grupo. As sinuosidades à sua direita indicam que por trás do link h3C- pode haver qualquer átomo ou substituinte; um alquil, r, aromático ou arilo, ar, ou um heteroácomo ou grupo funcional, como oh ou cl.
 O grupo metil é o mais simples dos substituintes carbonatados na química orgânica. Fonte: su-no-g [domínio público]
O grupo metil é o mais simples dos substituintes carbonatados na química orgânica. Fonte: su-no-g [domínio público] Quando o grupo funcional ligado ao metil é oh, temos álcool de metanol, CHO3Oh; E se for o CL, então teremos o cloreto de metila, CHO3Cl. Na nomenclatura orgânica, é mencionado simplesmente como 'metil' precedido pelo número de sua posição na cadeia de carbono mais longa.
O grupo Metilo Ch Group3 É fácil identificar durante as elucidações de estruturas orgânicas, especialmente graças à espectroscopia de ressonância magnética nuclear de carbono 13 (RMN C (RMN C13). Após a obtenção de oxidações fortes, os grupos ácidos são obtidos, sendo uma rota sintética para sintetizar os ácidos carboxílicos.
[TOC]
Representações
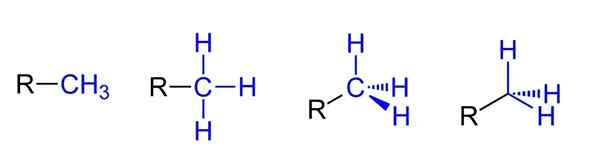 As possíveis representações para o grupo metil. Fonte: Jü via Wikipedia.
As possíveis representações para o grupo metil. Fonte: Jü via Wikipedia. Acima, você tem as quatro possíveis representações assumindo que Cho3 Está ligado a um substituinte rico r. Eles são todos equivalentes, mas enquanto os aspectos espaciais da molécula vão da esquerda para a direita.
Por exemplo, R-CH3 dá a impressão de que é plano e linear. A representação a seguir demonstra as três ligações covalentes C-H, que permitem identificar o metil em qualquer estrutura de Lewis e dar a falsa impressão de ser uma cruz.
Pode atendê -lo: o que é o erristenoo?Então, seguindo a direita (o penúltimo), a hibridação do SP é observada3 No carro Caron3 Por causa de sua geometria tetraédrica. Na última representação, o símbolo químico do carbono nem sequer está escrito, mas o tetraedro é mantido para indicar quais átomos H estão frontais ou atrás do plano.
Embora não esteja na imagem, outra maneira muito recorrente no momento de representar Cho3 Consiste em simplesmente colocar o script (-) "nu". Isso é muito útil quando grandes esqueletos de carbono são desenhados.
Estrutura
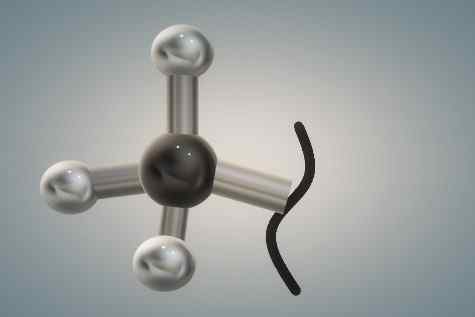 Estrutura do grupo metil representado pelo modelo de esferas e barras. Fonte: Gabriel Bolívar.
Estrutura do grupo metil representado pelo modelo de esferas e barras. Fonte: Gabriel Bolívar. A imagem superior é a representação tridimensional do primeiro. A esfera preta e lustrosa corresponde ao átomo de carbono, enquanto os brancos são átomos de hidrogênio.
Novamente, o carbono tem um produto ambiental tetraédrico de sua hibridação SP3, E, como tal, é um grupo relativamente volumoso, com as rotações de seu link C-R estericamente evitado; Isto é, ele não pode girar porque as esferas brancas interfeririam nas nuvens eletrônicas de seus átomos vizinhos e sentiriam sua repulsa.
No entanto, os links C-H podem vibrar, assim como o link C-R. Portanto, Cho3 É um grupo de geometria tetraédrica que pode ser elucidada (determinar, descobrir) por espectroscopia de radiação infravermelha (IR), como todos os grupos funcionais e ligações de carbono com heteroácromos.
O mais importante, no entanto, é sua elucidação através da RMN13. Graças a esta técnica, a quantidade relativa de grupos metila é determinada, o que permite que a estrutura molecular seja montada.
Pode atendê -lo: soluções valorizadasGeralmente, quanto mais grupos de CHA3 Ter uma molécula, mais "desajeitada" ou ineficiente serão suas interações intermoleculares; isto é, os menores serão seus pontos de fusão e ebulição. Os grupos cap3, Por causa de seus hidrogênios, eles "escorreguem" um com o outro quando se aproximam ou tocam.
Propriedades
O grupo metil é caracterizado por ser hidrofóbico e apolar.
Isso ocorre porque suas ligações C-H não são muito polares devido à baixa diferença entre o carbono e o hidrogênio eletronegividades; Além disso, sua geometria tetraédrica e simétrica distribui suas densidades eletrônicas quase homogeneamente, o que contribui para um momento desprezível dipolo.
Na ausência de polaridade, Cho3 "Água" de água, comportando -se como um hidrofóbico. Portanto, se for visto em uma molécula, será sabido que essa extremidade metil não interagirá com eficiência com água ou outro solvente polar.
Outra característica de CH3 É sua relativa estabilidade. A menos que o átomo que esteja ligado à densidade eletrônica de retirada permaneça praticamente inerte na frente de meios ácidos muito fortes. No entanto, será visto que pode participar de reações químicas, principalmente à sua oxidação ou migração (metilação) para outra molécula.
Reatividade
Oxidações
O ch3 não está isento de oxidar. Isso significa que é suscetível à formação de vínculos com oxigênio, C-O, se reagir com fortes agentes oxidantes. Como oxida, torna -se diferentes grupos funcionais.
Por exemplo, sua primeira oxidação dá origem ao grupo metaol (ou hidroximetil), CHO2Oh, um álcool. O segundo, deriva no grupo formil, Cho (hc = O), um aldeído. E a terceira final.
Pode atendê -lo: constante de ionizaçãoEsta série de oxidações é usada para sintetizar o ácido benzóico (HOOC-C-C6H5) Do tolueno (h3DC6H5).
Íons
O ch3 Durante o mecanismo de algumas reações, você pode ganhar cargas elétricas momentâneas. Por exemplo, quando o metanol é aquecido em um meio ácido muito forte, na ausência teórica de nucleófilos (mecanismos de busca de carga positiva), o cátion metílico é formado3+, Já que o link CHO está quebrado3-Ah e oh sai com o par de elétrons de ligação.
A espécie cap3+ É tão reativo que só foi capaz de ser determinado na fase gasosa, uma vez que reage ou desaparece à menor presença de um nucleófilo.
Por outro lado, Cho3 O ânion também pode ser obtido: Metanuro, CH3-, O carbanion mais simples de todos. No entanto, como Cho3+, Sua presença é anormal e só ocorre em condições extremas.
Reação de metilação
Na reação de metilação, um CH é transferido3 para uma molécula sem cargas elétricas (CHO3+ nem ch3-) no processo. Por exemplo, iodeto de metila, Cho3I, é um bom agente de metynt e posso substituir o link O-H de várias moléculas por um o-ch3.
Na síntese orgânica, isso não implica nenhuma tragédia; Mas quando o que é excessivamente metil são as bases de nitrogênio do DNA.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. Aminas. (10ª edição.). Wiley Plus.
- Rahul Gladwin. (23 de novembro de 2018). Metilação. Encyclopædia britannica. Recuperado de: Britannica.com
- Danielle Reid. (2019). Grupo metil: estrutura e fórmula. Estudar. Recuperado de: estudo.com
- Wikipedia. (2019). Grupo metil. Recuperado de: em.Wikipedia.org
- « Propriedades do Enegon, como fazer um Enegon, exemplos
- Conceito e fórmula de volume molar, cálculo e exemplos »

