Precipitado

- 1247
- 108
- Melvin Mueller
Explicamos o que é um precipitado, a reação de precipitação, os tipos que existem e damos vários exemplos
 Formação de precipitado amarelo ao misturar uma solução com um agente precipitado
Formação de precipitado amarelo ao misturar uma solução com um agente precipitado O que é um precipitado?
A precipitado É um sólido formado a partir de uma solução, seja pela cristalização de uma substância dissolvida ou pela formação de uma substância insolúvel através de uma reação química.
O primeiro caso ocorre quando uma substância sólida, que foi inicialmente dissolvida em um solvente como a água, se torna menos solúvel. Isso pode acontecer quando:
- A temperatura da solução diminui.
- Um agente precipitante é adicionado.
- Outro solvente é adicionado no qual o sólido é menos solúvel.
Quando sua solubilidade se torna menor que sua concentração, a solução fica supersaturada e uma reação de precipitação ocorre.
O segundo caso ocorre após qualquer reação química que gera um produto insolúvel ou muito pouco solúvel no solvente. Uma vez que este produto começa a se formar, a solução é rapidamente saturada e o sólido começa a precipitar.
Reação de precipitação química
A reação de precipitação é o processo químico que leva à formação de um precipitado. Dependendo de como o precipitado é formado, a reação pode ser escrita de duas maneiras diferentes:
- Se a precipitação ocorrer porque a solubilidade do sólido no solvente foi reduzida (resfriando ou adicionando outro solvente, por exemplo), a reação da precipitação envolve apenas o soluto e seria assim:

Por exemplo, Se o acetato de sódio se dissolve (CH-3Bolso) em água quente e depois deixado esfriar, o acetato de sódio precipitará de acordo com a seguinte equação:

- Se a precipitação ocorrer porque um agente precipitado foi adicionado, a reação de precipitação envolverá o soluto e o agente precipitado.
Por exemplo, Íons de prata (AG+) Eles podem precipitar de uma solução de nitrato de prata (AGNO3) Adicionando uma solução de cloreto de sódio ou NaCl (agente precipitado). A reação de precipitação neste caso é dada por:
Pode atendê -lo: cloreto de níquel (nicl2): estrutura, propriedades, obtenção, usos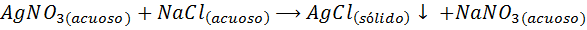
Mecanismo de precipitação
Independentemente da reação de precipitação, a formação do precipitado sempre ocorre em dois estágios chamados nucleação e crescimento:
-
Nucleação
No início da reação de precipitação, são formadas pequenas partículas de precipitado que são chamadas de núcleos, de modo que esse estágio é chamado de nucleação.
-
Crescimento
Após a nucleação, novas partículas não são mais formadas, mas os núcleos já formados começam a crescer até que a precipitação pare.
Tipos de precipitado
A velocidade com que os precipitados são formados afeta o tamanho das partículas sólidas e as propriedades do mesmo. Dependendo do tamanho das partículas e da natureza do composto precipitante, três tipos de precipitados podem ser distinguidos:
Precipita cristalina
É o tipo mais simples de precipitado. Nesse caso, o precipitado é composto de grandes partículas sólidas com um diâmetro maior que 0,1 micrômetros.
 Precipitado cristalino de sulfato de cobre (ii) penta -hidrato
Precipitado cristalino de sulfato de cobre (ii) penta -hidrato Precipitados cristalinos são formados quando a reação de precipitação ocorre lentamente. Isso permite que poucas partículas sólidas se formem durante a nucleação, e cada uma dessas partículas tem tempo suficiente para crescer e formar cristais grandes e pesados que caem no fundo da solução.
Essas partículas são quase sempre sólidas cristalinas com rostos planos e brilhantes, semelhantes às facetas de um diamante, e quase sempre podem ser distinguidas com as olhos nus.
Precipita caseouous
Eles são precipitados para partículas muito menores, entre 0,01 e 0,1 micrômetros de diâmetro. Esse tipo de precipitado é formado quando a reação de precipitação ocorre muito rapidamente, gerando muitas partículas durante a nucleação que não têm tempo para crescer.
Devido ao seu tamanho, essas partículas são muito leves e são suspensas na solução formando um colóide estável. Por esse motivo, eles não se estabelecem no fundo da solução e parece nublado em vez de transparente.
Pode atendê -lo: di -hidroxiacetona: estrutura, propriedades, obtenção, usos Três caseosos de cores diferentes. As três soluções são obscuras após a formação dos precipitados
Três caseosos de cores diferentes. As três soluções são obscuras após a formação dos precipitados Além disso, as partículas são tão pequenas que conseguem atravessar a maioria dos filtros que são usados para separar os precipitados das soluções.
Água Hacords
Quando as partículas são ainda menores que as dos precipitados caseous, ou seja, com diâmetros inferiores a 0,01 micrômetros, os precipitados são chamados de geléia. O motivo é porque o sólido adquire uma aparência semelhante à gelatina ou uma geléia.
Esses precipitados também são considerados colóides. De fato, a gelatina é um exemplo típico de um colóide, e esses precipitados tiram o nome do mesmo.
Exemplos característicos de geléia precipitada são os óxidos hidratados de alguns metais. Esses óxidos absorvem uma grande quantidade de água em sua superfície, o que o impede de formar partículas maiores que cristalizam.
Exemplos precipitados
Acetato de sódio (CH3Bolso)
Como mencionado acima, o acetato de sódio pode ser precipitado a partir de uma solução saturada quente que é permitida para esfriar. Se for permitido esfriar lentamente, é formado um precipitado cristalino no qual os longos cristais de agulha branca são observados.
Sulfeto de cádmio (II) (CDS)
O sulfeto de cádmio é um sal muito insolúvel que é imediatamente misturado em uma solução de íons de cádmio (II) com outro que contém íons sulfeto.
Sulfato de cobre (ii) penta -hidrato (CuO4.5h2QUALQUER)
Ao dissolvê -lo em água, o sulfato de cobre (ii) forma íons hidratados de azul intenso. Se a água evapora lentamente, precipite belos cristais azuis de cuso4.5h2QUALQUER. Esses cristais parecem pedras preciosas.
Brometo de prata (AGBR)
Este é um exemplo de um composto que precipita formação muito rápida de um precipitado com partículas muito finas que são difíceis de filtrar.
Pode atendê -lo: peso equivalenteÓxido hidratado de alumínio (iii) (para2QUALQUER3.NH2QUALQUER)
Este é um exemplo clássico da formação de um precipitado gelatinoso. É formado quando uma solução de nitrato de alumínio (não (não3)3).
Sulfeto de manganês (II) (MNS)
Muitos sulfídios são insolúveis em água e o sulfeto de manganês não é exceção. Isso precipita na forma de uma poeira muito fina.
Cloreto de prata (AGCL)
Íons de prata (i) formam muito pouco sais solúveis com todos os halogênios. O caso de cloreto de prata é um exemplo clássico de formação precipitada no laboratório.
Carbonato de cálcio (caco3)
Cálcio é um dos íons responsáveis pela dureza da água. Quando a água que contém cálcio é aquecida, reage formando carbonato de cálcio que precipita na forma de uma camada branca chamada tártaro, que é capaz de obstruir os tubos.
Óxido hidratado de ferro (iii) (fé2QUALQUER3.NH2QUALQUER)
Este é outro exemplo de precipitado gelatinoso formado pela reação de uma solução contendo íons de ferro (III) com hidróxido de sódio ou potássio.
Hidróxido de magnésio (mg (oh)2)
O magnésio é o outro cátion responsável pela dureza da água, pois pode precipitar na forma de hidróxido de magnésio em tubos e outros sistemas de aquecimento de água.
Referências
- Bancoft, w. D. (1918). Esboço da química colóide.-Iii. Jornal do Instituto Franklin, 185(3), 373-387. https: // doi.org/10.1016/S0016-0032 (18) 90710-6
- Civan, f. (2007). Crescimento de cristais e formação de escala em meios porosos. Dano de formação de reservatório, 235-255. https: // doi.org/10.1016/b978-075067738-7/50010-5
- Skoog, d. PARA., Oeste, d. M., Holler, f. J., & Crouch, S. R. (2013). Fundamentos da química analítica. Nova York, Nova York: Cengage Learning.
- Colaboradores da Wikipedia. (2021, 10 de janeiro). Precipitação (química). Recuperado de.Wikipedia.org

