Diferenças entre compostos orgânicos e inorgânicos

- 1275
- 332
- Lonnie MacGyver
As Diferenças entre compostos orgânicos e inorgânicos Eles nem sempre são simples, nem obedecem a uma regra imutável, porque em termos de química existem sinfinas de exceções que contradizem ou questionam o conhecimento anterior. No entanto, existem características que permitem discernir entre muitos compostos que ou não ou não inorgânicos.
Por definição, a química orgânica é o estudo que inclui todos os ramos da química de carbono; Portanto, é lógico pensar que seus esqueletos são compostos de átomos de carbono. Por outro lado, esqueletos inorgânicos (sem entrar em polímeros) são geralmente compostos de qualquer outro elemento da tabela periódica que não seja carbono.
Os seres vivos, em todas as suas escalas e expressões, são praticamente feitos de carbono e outros heteroátomos (H, O, N, P, S, etc.). Então, toda a vegetação que cobre a crosta terrestre, bem como as criaturas que andam nela, são exemplos vivos de compostos orgânicos misturados complexos e dinamicamente.
Por outro lado, perfurando a terra e nas montanhas, encontramos ricos corpos minerais em composição e formas geométricas, que em sua grande maioria são compostos inorgânicos. Este último também define quase inteiramente a atmosfera que respiramos, e os oceanos, rios e lagos.
Compostos orgânicos | Compostos inorgânicos | |
Átomos que o compõem | Eles contêm átomos de carbono. | Eles são compostos por outros elementos que não o carbono. |
Eles fazem parte de .. | Fazem parte dos seres vivos. | Eles fazem parte de seres inertes. |
Fontes em que são | Eles são menos abundantes em fontes naturais. | Eles são mais abundantes em fontes naturais. |
Tipos de compostos | Eles geralmente são moleculares. | Eles geralmente são iônicos. |
Tipos de links | Links covalentes. | Links iônicos. |
Massas molares | Massas molares maiores. | Massas molares inferiores. |
Diversidade | Eles são menos diversos. | São elementos mais diversos. |
Pontos de fusão e de ebulição | Pontos menores de fusão e de ebulição. | Pontos de fusão e fervura mais altos. |
Principais diferenças entre compostos orgânicos e inorgânicos
Os compostos inorgânicos são obtidos de fontes naturais mais abundantes do que as de compostos inorgânicos
 Cristais de açúcar (direita) e sal (esquerda) visto no microscópio. Fonte: Oleg Panichev [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Cristais de açúcar (direita) e sal (esquerda) visto no microscópio. Fonte: Oleg Panichev [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Embora possa haver exceções, os compostos inorgânicos são geralmente obtidos de fontes naturais mais abundantes do que as para compostos orgânicos. Essa primeira diferença leva a uma declaração indireta: os compostos inorgânicos são mais abundantes (na terra e no cosmos) do que os compostos orgânicos.
Obviamente, em um local de petróleo, hidrocarbonetos e predominados relacionados predominarão, que são compostos orgânicos.
Voltando à seção, ela pode ser mencionada no sal do açúcar como um exemplo. Os cristais de açúcar (mais robustos e facetados) e sal são mostrados acima (menores e arredondados).
O açúcar é obtido, após uma série de processos, de plantações de cana (em regiões ensolaradas ou tropicais) e beterraba (em regiões frias ou no início de invernos ou outono). Ambos são matérias -primas naturais e renováveis, que são cultivadas até a colheita adequada.
Pode atendê -lo: padronização de soluçõesEnquanto isso, o sal vem de uma fonte muito mais abundante: o mar, ou lagos e sais como o Halita Mineral (NACL). Se todas as beterrabas de cana e açúcar fossem reunidas, elas nunca poderiam corresponder às reservas de sal natural.
Os cristais inorgânicos são geralmente iônicos, enquanto os cristais orgânicos tendem a ser moleculares
Tomando o par de açúcar novamente como exemplo, sabemos que o açúcar consiste em um dissacarídeo chamado sacarose, que por sua vez se desintegra em uma unidade de glicose e outra de frutose. Os cristais de açúcar são moleculares, pois são definidos por sacarose e suas pontes intermoleculares de hidrogênio.
Enquanto isso, os cristais salgados constituem uma rede de íons de Na+ e cl-, que define uma estrutura cúbica centrada nos rostos (FCC).
O ponto central é que os compostos inorgânicos geralmente formam cristais iônicos (ou pelo menos, possuindo um caráter iônico alto). No entanto, existem várias exceções, como cristais de CO2, H2S, então2 e outros gases inorgânicos, que se solidificam em baixas temperaturas e altas pressões, e também são moleculares.
A água representa a exceção mais importante para este ponto: o gelo é um cristal inorgânico e molecular.
 Os poucos neve ou gelo são cristais de água, excelentes exemplos de cristais moleculares inorgânicos. Fonte: Sieverschar de Pixabay.
Os poucos neve ou gelo são cristais de água, excelentes exemplos de cristais moleculares inorgânicos. Fonte: Sieverschar de Pixabay. Os minerais são em essência compostos inorgânicos, e seus cristais são, portanto, predominantemente de natureza iônica. É por isso que esse segundo ponto é considerado válido para um amplo espectro de compostos inorgânicos, incluindo sais, sulfetos, óxidos, telores, etc.
O tipo de link que governa em compostos orgânicos é covalente
Os mesmos cristais de açúcar e sal deixam algo pergunta: os primeiros contêm links covalentes (direcionais), enquanto os últimos exibem links iônicos (não direcionais) (não -direcional).
Este ponto está diretamente correlacionado com o segundo: um cristal molecular deve necessariamente ter múltiplas ligações covalentes (compartilhando alguns elétrons entre dois átomos).
Novamente, os sais orgânicos estabelecem certas exceções, uma vez que também têm um caráter fortemente iônico; Por exemplo, benzoato de sódio (c6H5Pata) é um sal orgânico, mas dentro do benzoato e seu anel aromático existem ligações covalentes. Mesmo assim, diz -se que seus cristais são iônicos, dada a interação eletrostática: c6H5COO- N / D+.
Em compostos orgânicos, as ligações covalentes entre átomos de carbono predominam
Ou o que é o mesmo a dizer: os compostos orgânicos consistem em esqueletos carbonatados. Neles, existe mais de uma ligação C-C ou C-H, e esse esqueleto pode ser linear, sombrio ou ramificado, variando no grau de sua insaturação e no tipo de substituinte (heteroaátomos ou grupos funcionais). Em açúcar, links C-C, C-H e C-OH abundam.
Pode servir a você: Redutor Agente: Conceito, os Exemplos mais fortesVamos dar como exemplo o CO, cap2OCH2 e h2C2QUALQUER4. Quais desses três compostos são inorgânicos?
Polegada2OCH2 (dióxido de etileno) Existem quatro ligações C-H e dois links C-O, enquanto em H2C2QUALQUER4 (ácido oxálico) Existem um C-C, dois C-OH e dois C = O. A estrutura de H2C2QUALQUER4 Pode ser escrito como hooc-cooh (dois grupos carboxila ligados). Enquanto isso, o CO consiste em uma molécula geralmente representada com uma ligação híbrida entre C = O e C≡O.
Como no CO (monóxido de carbono) existe apenas um átomo de carbono ligado a um de oxigênio, esse gás é inorgânico; Os outros compostos são orgânicos.
Compostos orgânicos geralmente têm massas molares maiores
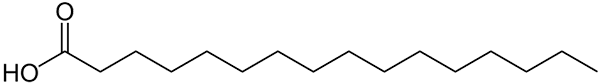 Estrutura representada com linhas de ácido palmítico. A grande coisa que é comparada a compostos inorgânicos menores, ou o peso da fórmula de seus sais pode ser notado. Fonte: Wolfgang Schaefer [Domínio Público]
Estrutura representada com linhas de ácido palmítico. A grande coisa que é comparada a compostos inorgânicos menores, ou o peso da fórmula de seus sais pode ser notado. Fonte: Wolfgang Schaefer [Domínio Público] Novamente, existem inúmeras exceções a essas regras, mas geralmente compostos orgânicos tendem a ter massas molares maiores devido ao seu esqueleto carbonatado.
Por exemplo, os molares dos compostos acima são: 28 g/mol (CO), 90 g/mol (H2C2QUALQUER4) e 60 g/mol (escolha2OCH2). Claro, o CS2 (Dissulfeto de carbono), composto inorgânico e cuja massa molar é 76 g/mol ", pesa" mais do que Cho2OCH2.
Mas e as gorduras ou ácidos graxos? De biomoléculas como DNA ou proteínas? Ou de extensos hidrocarbonetos de cadeia linear? Ou asfalteno? Suas massas molares excedem facilmente 100 g/mol. Ácido palmítico (imagem superior), por exemplo, tem uma massa molar de 256 g/mol.
Compostos orgânicos são mais abundantes em número
Alguns compostos inorgânicos, chamados complexos de coordenação, apresentam a Isomeía. No entanto, isso é menos diversificado em comparação com a isoméria orgânica.
Mesmo se adicionarmos todos os sais, óxidos (metálicos e não -metálicos), sulfetos, telururos, carbonetos, hidretos, nitretos, etc., Talvez não reuniríamos nem metade dos compostos orgânicos que podem existir na natureza. Portanto, os compostos orgânicos são mais abundantes em número e mais ricos em estruturas.
Os compostos inorgânicos são elementares mais diversos
No entanto, de acordo com a diversidade elementar, os compostos inorgânicos são mais variados. Porque? Porque com a tabela periódica na mão, você pode construir qualquer tipo de composto inorgânico; Enquanto um composto orgânico é limitado apenas aos elementos: C, H, O, P, S, N e X (halogênios).
Temos muitos metais (alcalinos, alcalinos, transição, lantanídeos, actinídeos, os do bloco P) e infinitos de opções para combiná -los com vários ânions (inorgânicos comuns); como: CO32- (Carbonatos), CL- (Cloretos), P3- (fosfuros), ou2- (óxidos), Oh- (hidróxidos), então42- (sulfatos), CN- (Cyanides), SCN- (Tiocianos) e muito mais.
Observe que os ânions CN- e scn- Eles parecem ser orgânicos, mas são realmente inorgânicos. Outra confusão é o ânion oxalato, c2QUALQUER42-, que é orgânico e não -inorgânico.
Pode atendê -lo: regra diagonalCompostos inorgânicos têm maiores pontos de fusão e ebulição
Novamente, existem várias exceções a essa regra, pois tudo depende de qual par de compostos é comparado. No entanto, mantendo -se a sais inorgânicos e orgânicos, os primeiros geralmente têm maiores pontos de fusão e ebulição do que este último.
Aqui encontramos outro ponto implícito: os sais orgânicos são suscetíveis à decomposição, porque o calor quebra suas ligações covalentes. Mesmo assim, comparamos o cálcio Tartrato par (CAC4H4QUALQUER6) e carbonato de cálcio (caco3). O CAC4H4QUALQUER6 Se decompõe a 600 ° C, enquanto o caco3 Derrete a 825 ° C.
E que o caco3 está longe de ser um dos sais com os pontos de fusão mais altos, como nos casos do CAC2 (2160 ºC) e CAS2 (2525 ºC): carburo e sulfeto de cálcio, respectivamente.
Compostos orgânicos são mais raros no universo
Os compostos orgânicos mais simples e primitivos, como metano, CHO4, Urerea, CO (NH2)2, ou a glicina de aminoácidos, NH2CH2COOH, são espécies muito raras no cosmos em comparação com amônia, dióxido de carbono, óxidos de titânio, carvão, etc. No universo, mesmo os materiais precursores da vida não são frequentemente detectados.
Os compostos orgânicos sustentam a vida em um grau muito maior do que o inorgânico
 A concha de um Morrocoy consiste em uma mistura de ossos cobertos pela queratina, composta por uma matriz inorgânica (hidroxiapatita e minerais relacionados) e orgânico (colágeno, cartilagem e nervos). Fonte: Morrocoy_ (Geochelone_Carbonary).JPG: a fotografia.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
A concha de um Morrocoy consiste em uma mistura de ossos cobertos pela queratina, composta por uma matriz inorgânica (hidroxiapatita e minerais relacionados) e orgânico (colágeno, cartilagem e nervos). Fonte: Morrocoy_ (Geochelone_Carbonary).JPG: a fotografia.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] A química de carbono, orgânica, aplicada no entendimento dos processos metabólicos, torna -se bioquímica (e do ponto de vista dos cátions metálicos, em bioinorgânico).
Os compostos orgânicos são a pedra angular da vida (como o Morrocoy da imagem superior), graças aos links C-C e ao enorme conglomerado de estruturas resultantes desses links e à sua interação com cristais de sais inorgânicos.
Voltando ao par de sal do açúcar, as fontes naturais de açúcar estão vivas: são colheitas que se desenvolvem e morrem; Mas isso não acontece o mesmo com as fontes do sal: os mares ou os depósitos salinos estão vivos (em um sentido fisiológico).
Plantas e animais sintetizam compostos orgânicos sem fim, que integram uma extensa gama de produtos naturais (vitaminas, enzimas, hormônios, gorduras, corantes, etc.).
No entanto, não podemos deixar de fora o fato de que a água é o solvente da vida (e é inorgânico); Nem que o oxigênio é indispensável para a respiração celular (sem nomear cofatores de metal, que não são compostos inorgânicos, mas cátions). Portanto, inorgânico também desempenha um papel crucial na definição de vida.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. Aminas. (10ª edição.). Wiley Plus.
- Helmestine, Anne Marie, Ph.D. (3 de julho de 2019). A diferença entre orgânico e inorgânico. Recuperado de: pensamento.com
- Agência de Educação do Texas. (2019). Orgânico ou inorgânico? Recuperado de: Texasgateway.org
- Sacarose. (s.F.). Como o açúcar é feito: uma introdução. Recuperado de: sucrosa.com
- Wikipedia. (2019). Lista de compostos inorgânicos. Recuperado de: em.Wikipedia.org
- « Diferenças entre velocidade e velocidade (com exemplos)
- 10 dinâmica de inteligência emocional para crianças e adultos »

