Ácido píchric o que é, estrutura, síntese, propriedades
- 1474
- 161
- Melvin Mueller
Ele Ácido píchrico É um composto químico orgânico altamente nitrado cujo nome IUPAC é 2,4,6-trinitrofenol. Sua fórmula molecular é C6H2(NÃO2)3Oh. É um fenol muito ácido e pode ser encontrado como picrato de sódio, amônio ou potássio; isto é, em sua forma iônica C6H2(NÃO2)3COM UM.
É um sólido sabor forte de amargo e a partir daí deriva seu nome, da palavra grega 'Prikos', o que significa amargo. É encontrado como cristais amarelos molhados. Sua dessecação ou desidratação é perigosa, pois aumenta as propriedades instáveis que a tornam explosiva.
O ácido píchric é usado como base para a síntese de corantes de tom amarelo permanente. Alguns patologistas e pesquisadores o usam na fixação ou coloração de seções de tecido e outros processos imuno -histoquímicos.
É muito útil no desenvolvimento de produtos farmacêuticos. Além disso, é usado na elaboração de fósforos ou fósforos e explosivos. Também é usado para gravar metais, fazer vidro colorido e na determinação colorimétrica de parâmetros biológicos, como a creatinina.
Estrutura
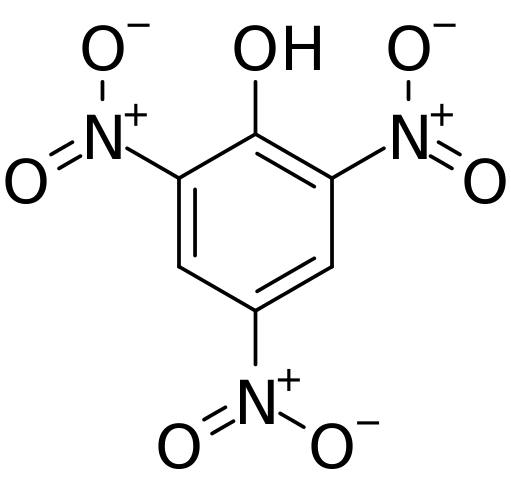
 Estrutura e cargas formais no ácido picórico. Fonte: CVF-PS [domínio público]
Estrutura e cargas formais no ácido picórico. Fonte: CVF-PS [domínio público] Na imagem superior, todas as ligações e a estrutura em si da molécula de ácido píchric são mostradas em mais detalhes. Consiste em um fenol com três substituintes nitro.
Pode -se ver que em grupos não2 O átomo de nitrogênio tem uma carga parcial positiva e, portanto, demanda por densidade eletrônica de seus arredores. Mas, o anel aromático também atrai os elétrons em sua direção e antes dos três não2 acaba dando parte de sua própria densidade eletrônica.
Como conseqüência disso, o oxigênio do grupo OH tende mais a compartilhar um de seus pares eletrônicos gratuitos para fornecer a deficiência eletrônica sofrida pelo anel; E, ao fazer isso, o link c = o é formado+-H. Essa carga parcial positiva no oxigênio enfraquece a ligação O-H e a acidez aumenta; isto é, será lançado como íon hidrogênio, h+.
Fenol ácido
É por esse motivo que este composto é um ácido excepcionalmente forte (e reagente), ainda mais do que o próprio ácido acético. No entanto, o composto é realmente um fenol cuja acidez ultrapassa a dos outros fenóis; devido, como acaba de mencionar, os substituintes não2.
Pode atendê -lo: processos termodinâmicosPortanto, como é um fenol, o grupo OH tem prioridade e direciona a enumeração na estrutura. Os três não2 Eles estão localizados em carbonos 2, 4 e 6 do anel aromático em relação a Oh. A partir daqui, deriva a nomenclatura da IUPAC para este composto: 2,4,6-trinitrofenol (TNP).
Se os grupos não fossem2, Ou se houvesse um número menor deles no ringue, o link O-H enfraqueceria menos e, portanto, o composto teria menos acidez.
Estrutura cristalina
As moléculas de ácido pícrico são ordenadas de tal maneira que favorecem suas interações intermoleculares; para a formação de pontes de hidrogênio entre os grupos OH e não2, Forças Dipolo-Dipolo, ou repulsões eletrostáticas entre as regiões de elétrons pobres.
Pode -se esperar que os grupos não2 Eles se repelem e orientação na direção dos anéis aromáticos vizinhos. Da mesma forma, os anéis não puderam alinhar um um no outro devido a um aumento de repulsões eletrostáticas.
Como resultado de todas essas interações, o ácido píchric consegue formar uma rede tridimensional que define um cristal; cuja célula unitária corresponde a um sistema cristalino do tipo ortorrômbico.
Síntese
Inicialmente, foi sintetizado a partir de compostos naturais, como derivados de chifre animal, resinas naturais, entre outros. A partir de 1841, o fenol tem sido usado como precursor do ácido picrico, seguindo várias rotas ou através de vários procedimentos químicos.
Como já disse, é um dos fenóis mais ácidos. Para sintetizá -lo, é necessário primeiro que o fenol sofra um processo de sulfonação, seguido por um procedimento de nitração.
A sulfonação do fenol anidro é realizada ao tratar o fenol com ácido sulfúrico de fumaça, ocorrendo substituições eletrofílicas aromáticas de H por grupos sulfonatos, portanto3H, na posição -Orto e -para em relação ao grupo OH.
Este produto, ácido 2,4-pynoldisulfônico, o processo de nitração é realizado, tratando-o com ácido nítrico concentrado. Ao fazer isso, os dois grupos SO3H são substituídos por grupos nitro, não2, E um terceiro entra na outra posição nitro. A equação química a seguir ilustra isso:
Pode atendê -lo: materiais elásticos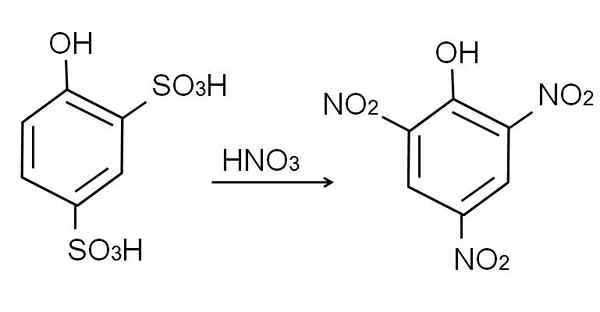 Nitração ácida 2,4-fenoldisulfônica. Fonte: Gabriel Bolívar.
Nitração ácida 2,4-fenoldisulfônica. Fonte: Gabriel Bolívar. Nitração direta do fenol
O processo de nitração do fenol não pode ser realizado diretamente, uma vez que os alvos de alto peso molecular são gerados. Este método de síntese precisa de um controle muito cuidadoso da temperatura, pois é muito exotérmico:
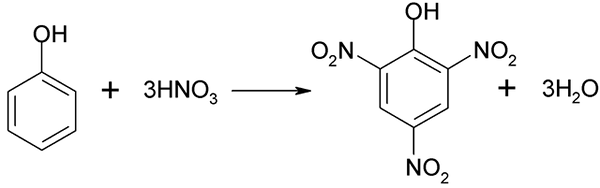 Nitração direta do fenol. Fonte: Akane700 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Nitração direta do fenol. Fonte: Akane700 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] O ácido píchric pode ser obtido ao realizar o processo de nitração direta de 2.4 dinitrofenol, com ácido nítrico.
Outra forma de síntese é tratar o benzeno com ácido nítrico e nitrato mercúrico.
Propriedades físicas e químicas
Peso molecular
229.104 g/mol.
Aparência física
Massa amarela de cristais úmidos.
Cheiro
É o banheiro.
Sabor
É muito amargo.
Ponto de fusão
122.5 ° C.
Ponto de ebulição
300 ° C. Mas, ao derreter, explode.
Densidade
1,77 g/ml.
Solubilidade
É um composto solúvel em água moderadamente. Isso ocorre porque seus grupos OH e não2 Eles podem interagir com moléculas de água por pontes de hidrogênio; Embora o anel aromático seja hidrofóbico, e é por isso que prejudica sua solubilidade.
Corrosividade
O ácido pycrico é corrosivo em geral para metais, exceto em estanho e alumínio.
Pka
0,38. É um ácido orgânico forte.
Instabilidade
O ácido píchric é caracterizado por possuir propriedades instáveis. Constitui um risco para o meio ambiente, é instável, explosivo e tóxico.
Deve ser armazenado bem fechado para evitar a desidratação, uma vez que o ácido picric é muito explosivo se for permitido secar. Você deve ter muito cuidado com sua forma anidro, porque é muito sensível ao atrito, golpes e calor.
O ácido pychral deve ser armazenado em locais frescos ventilados, longe de materiais oxidáveis. É irritante entrar em contato com a pele e as membranas mucosas, ela não deve ser ingerida e é tóxica para o corpo.
Formulários
O ácido píchric tem sido amplamente utilizado na área de pesquisa, em química, na indústria e no campo militar.
Investigação
Quando usado como fixador de células e tecidos, melhora os resultados da cor com corantes ácidos. Isso acontece com métodos de coloração tricrômica. Depois de definir o tecido com formalina, recomenda -se uma nova fixação com ácido pícrico.
Pode servir a você: pressione Filtro: características, partes, como funciona, usaDessa maneira, uma coloração intensa e muito brilhante dos tecidos é garantida. Bons resultados são obtidos com corantes básicos. No entanto, as precauções devem.
Quimica Organica
-Na química orgânica, é usado como picratos alcalinos para fazer identificação e análise de várias substâncias.
-É usado em química analítica de metal.
-Nos laboratórios clínicos, é usado para determinar os níveis séricos e urinários da creatinina.
-Também tem sido usado em alguns dos reagentes usados para a análise dos níveis de glicose.
Na indústria
-No nível da indústria fotográfica, o ácido píchric tem sido usado como sensibilizador em emulsões fotográficas. Fez parte da elaboração de produtos como pesticidas, inseticidas fortes, entre outros.
-O ácido píchric é usado para sintetizar outros compostos químicos intermediários, como cloropicrina e ácido picâmico, por exemplo. A partir desses compostos, alguns medicamentos e corantes para a indústria de couro foram desenvolvidos.
-O ácido píchric foi usado no tratamento de queimaduras, como condições anti -sépticas e outras, antes que sua toxicidade fosse evidenciada.
-Componente importante por sua natureza explosiva na elaboração de fósforos e baterias.
Aplicações militares
-Devido à alta explosividade do ácido píchric, foi usado em plantas de munição de armas militares.
-Ácido píchric pressionado e fundido em projéteis de artilharia, bombas e minas foram usadas.
-O sal de amônio de ácido pícólico tem sido usado como explosivo, é muito poderoso, mas menos estabilidade do que TNT. Por um tempo foi usado como um componente de combustível de foguete.
Toxicidade
Está provado que é muito tóxico para o organismo humano e, em geral, para todos os seres vivos.
Recomenda -se evitar sua inalação e ingestão, para ter toxicidade oral aguda. Também causa mutação em microorganismos. Apresenta efeitos tóxicos na vida selvagem, em mamíferos e em geral no ambiente.
Referências
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Universidade de Purdue. (2004). Explosão de ácido picrico. Recuperado de: Chemed.Chem.Purdue.Edu
- « Biografia, teoria e outras contribuições de Patricia Benner
- Maguey o que é, características, habitat, reprodução »

