Ácido fraco
- 4137
- 270
- Melvin Mueller
 Exemplos de ácido fraco
Exemplos de ácido fraco O que é um ácido fraco?
Um ácido fraco é aquele que em solução aquosa tem pouca capacidade de se dissociar em hidrogênio (h+) e em sua base conjugada correspondente. Ao contrário dos ácidos fortes, cuja dissociação está completa (100%) e praticamente irreversível, os ácidos fracos são quase dissociados e reversíveis.
Portanto, um ácido fraco gera menos tons h+ Na água do que seria esperado. Entre os ácidos fracos mais representativos, temos ácido acético, o principal componente do vinagre, que está aproximadamente em um 0.5 % em condições normais.
Isso significa que a maior proporção de uma solução de ácido acético na água, como 5%de vinagre de cozimento, está em forma não dissociada (CH3COOH); Enquanto uma pequena porção é encontrada como a base do conjugado (escolha3COO-), acompanhado por íons h+, ou mais corretamente, íons h3QUALQUER+.
Então, como a quantidade de hidrogênio que é liberada por um ácido fraco em solução aquosa é baixa, o pH que eles produzem é maior (básico) do que o produzido por um ácido forte. Por exemplo, o vinagre tem um pH de 2.5, suco de laranja pH 3.3. 4.2 e o suco de limão 2 de 2.
Esses pH, embora sejam ácidos, são mais altos que o pH que produz uma solução de um ácido forte (hcl, h2SW4, etc.) que eles podem atingir o valor de 1 ou menos (valores de pH negativos).
Características de ácidos fracos
Ph de suas soluções
Ácidos fracos geralmente têm um pH entre 2.0 e menos de 7.0, então eles giram a cor do papel de panasol em vermelho. Esses valores de pH são muitos maiores que os valores de pH produzidos por ácidos fortes, embora existam exceções.
Por exemplo, uma solução de ácido clorídrico de 1 mm (um ácido forte), tem um pH de 3.0, enquanto uma solução de 1 mm de ácido fluorérico (um ácido "fraco") tem um pH de 3.2, que é próximo ao de ácido forte.
Ionização parcial
Os ácidos fracos em solução são pouco ionizados ou parcialmente em água, dissociando -se na base conjugada de ácido e íon hidrogênio. Então, um ácido fraco em solução aquoso é principalmente dissociado, com uma pequena proporção dissociada.
Pode atendê -lo: balanceamento de equações químicasQuando a quantidade de hidrogênio liberada por um ácido fraco na água é baixa, o pH produzido por esse ácido é maior do que o produzido por um ácido forte dissolvido na água, pois estes são geralmente ionizados por 100 %.
Ionização reversível
A ionização de um ácido fraco geralmente é esquematizada da seguinte forma:
Tem ⇌ a- + H3QUALQUER-
Onde está há ácido fraco, para- sua base conjugada, e H3QUALQUER+ o cátion do hidrônio, que é o caminho em H+ Existe ou manifestado na água. A concentração (ou atividade) de H3QUALQUER+ É usado em vez de h+ Para a determinação da solução da solução.
Grau de ionização
Alguns ácidos são mais fracos que outros, o que é o mesmo a dizer, eles são menos ionizados. Portanto, o grau de ionização nos permite vislumbrar o quão ácido um ácido sob certas condições é.
Para expressar o grau de ionização, foram introduzidos vários parâmetros, como a ionização ou constante de acidez (KA) e a PKA: uma maneira de expressar Ka em um número simples que omite o uso de um número expresso em poderes negativos de dez (10 ), como existe no ka.
As constantes de ka e pka são usadas principalmente para ácidos fracos.
Ka = [a-] [H+] / [Ha]
Os colchetes presentes na fórmula representam concentrações.
pka = - log ka
O valor da PKA de um ácido fraco geralmente varia entre 2 e 12. Mas há exceções. Por exemplo: e e ácido odagical (hio3) tem um PKA de 0.77, que é considerado um valor relativamente pequeno, mas sem ser negativo, para um ácido fraco em um sentido estrito.
Estabilidade da base conjugada
Os ácidos fracos têm uma ligação forte com átomo de hidrogênio ácido (hδ+-Xδ-), então eles têm um baixo grau de dissociação de hidrogênio. Isso resulta na base conjugada de ácido fraco tem grande avidez pelo hidrogênio, sendo uma base conjugada forte.
Pode atendê -lo: colóideIsto é, a base conjugada de um ácido fraco é muito instável, porque aceita h+ retornou com muita facilidade. Quanto mais instável essa base conjugada, mais fraco o ácido estará em questão.
Baixa condutividade iônica
Sendo pouco ionizados, os ácidos fracos são condutores de eletricidade pobres, ao contrário de ácidos fortes que são bons condutores de eletricidade.
Presença na natureza
Os ácidos fracos são amplamente distribuídos na natureza, por exemplo, estão em frutas cítricas (limão, toranja, laranja, etc.).
Eles também estão presentes em vários processos que ocorrem em todos os seres vivos. Alguns desses ácidos fracos biológicos são piruvicos, láticos, cítricos, fumáticos, succínicos, glutâmicos, etc., e até a hemoglobina oxigenada libera hidrogenions, por isso se comporta como um ácido fraco.
Então, pode -se concluir que o homem vive em contato permanente com ácidos fracos.
Como calcular o pH de um ácido fraco?
O pH de um ácido fraco pode ser calculado usando a constante de acidização (KA) ou usando a equação de Henderson-Haselbalch. No primeiro exemplo, o KA será usado.
Com constante de acidez
Calcule o pH de uma solução 0.5 m de ácido benzóico (C6H5COOH), que possui uma constante de ionização (ka) = 1.8 x 10-5
C6H5COOH ⇌ c6H5COO- + H+ (1)
Se a quantidade de ácido que se dissocia for chamada x, então 0.5 M-X será a concentração de ácido fraco não dissociado em equilíbrio, sendo a concentração da base do conjugado de ácido benzóico e concentração de íons de hidrogênio.
A equação (1) pode ser representada da seguinte maneira:
0.5 m-x ⇌ x +x
Os ácidos fracos são ionizados em uma proporção muito baixa, portanto a concentração de ácido benzóico no equilíbrio de (0.5 m-x), pode ser assumido como 0.5 m, desde x <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5m
X2 = (1.8 x 10-5) (0.5m)
X = 3 x 10-3 M
Portanto, [H+] é igual a 3 x 10-3 M. Nós resolvemos então calculando o pH:
Pode servir a você: Método Mohr: Fundamentos, Reações, Procedimento, Usosph = - log [h+]
= - log [3 x 10-3]
pH = 2.52
Observe que o pH é relativamente ácido, pois está localizado abaixo de 3 ou 4.
Com a equação de Henderson-Haselbalch
A equação de Henderson-Haselbalch é usada para calcular o pH de uma solução tampão:
ph = pka + log [base conjugada] / [ácido]
Exemplo:
O hidróxido de sódio (NaOH) é adicionado a uma solução de ácido acético, produzindo uma concentração final de ácido acético (CH3COOH) 1.11 x 10-2 mol/l e uma concentração de base conjugada (escolha3COO-) de 0.44 x 10-2 mol/l. Se o ácido acético PKA for 4.75 Calcule o pH da solução.
pH = 4.75 +log [a-] / [Ha]
pH = 4.75 +log (0.44 x 10-2 / 1.11 x 10-2)
= 4.75+ log 0.396
= 4.348
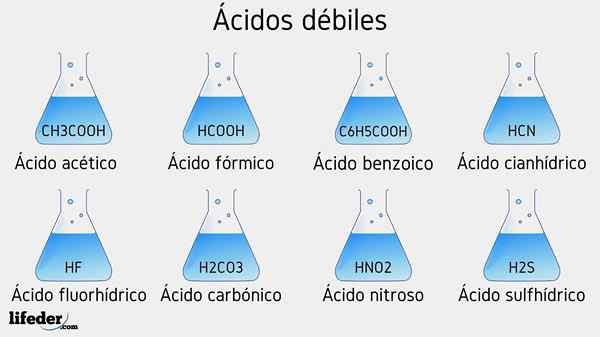
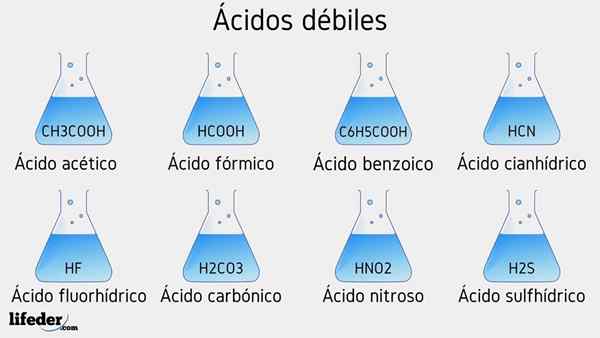
Exemplos de ácido fraco
Vários ácidos fracos acompanhados por seus valores de PKA serão listados abaixo:
- CH3COOH (ácido acético), PKA 4.75
- HCOOH (ácido fórmico), PKA 3.74
- C6H5COOH (ácido benzóico), PKA 5.59
- CH2CLCOOH (ácido cloroacético), PKA 2.85
- HCN (ácido canífrico), PKA 9.31
- HF.17
- C2H5COOH (ácido propiônico), PKA 4.89
- Hno2 (Ácido nitroso), pka 3.35
- H2S (ácido sulfeto), pka1 6.0 e pka2 12.92
- Ccl3COOH (ácido tricloroacético), pka 0.52
- H2Co3 (ácido carbônico), pka1 6.37 e PKA2 10.22
- H3Po4 (ácido fosfórico), pka1 2.12, pka2 4.21 e pka3 onze.0
- C6H5SW3H (ácido benzefônico), pka 0.70
- Hio3 (Ácido yodium), pka 0.77
- HCLO2 (Ácido cloro), pka 2.0
- CH3CH2(OH) COOH (ácido lático), PKa 3.08
Ácidos fracos com usos terapêuticos
- Ácido salicílico, pka 3.00
- Ácido acetilsalicílico, pka 3.49
- Furosemida, pka 3.90
- Ibuprofeno, pka 4.40
- Levodopa, pka 2.30
- Fenobarbital, PKa 7.40
- Warfarina, PKA 5.0
- Teofilina, PKA 8.80
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Morris, J. G. (1974). Físico -química para biólogos. (2ª ed.). Eu revertei.
- Helmestine, Anne Marie, Ph.D. (29 de agosto de 2020). Definição de ácido fraco e exemplo na química. Recuperado de: pensamento.com
- Ophardt c., & McCarthy l. (15 de agosto de 2020). Ácido e força de base. Química Librettexts. Recuperado de: química.Librettexts.org
- Clark Jim. (2013). Ácido forte e fraco. Recuperado de: Chemguide.co.Reino Unido
- Learning de lúmen. (s.F.). Química para não-Majors: calculando o pH de soluções de ácido fraco e base. Recuperado de: cursos.Lumenarning.com

