Peças de células galvânicas, como funciona, aplicações, exemplos

- 2402
- 369
- Melvin Mueller
O Célula galvânica O Célula Voltaica é um tipo de célula eletroquímica que consiste em dois metais diferentes imersos em dois semi -ladrões, nos quais um composto em solução ativa é uma reação espontânea.
Então, um dos metais em um dos semi -ladrões é oxidado enquanto o metal da outra semi -media é reduzido, produzindo uma troca de elétrons através de um circuito externo. Isso permite aproveitar a corrente elétrica.
 figura 1. Esquema e partes de uma célula galvânica. Fonte: Corinto.PUCP.Edu.educaçao Fisica.
figura 1. Esquema e partes de uma célula galvânica. Fonte: Corinto.PUCP.Edu.educaçao Fisica. O nome de "Galvanic Cell" é em homenagem a um dos pioneiros da experimentação com a eletricidade: o médico e fisiologista italiano Luigi Galvani (1737-1798).
Galvani descobriu em 1780 que, se eles se uniram por uma extremidade de cabos de metais diferentes e as extremidades livres foram colocadas em contato com o ANCA de um sapo (morto), então uma contração ocorreu.
No entanto, o primeiro a construir uma célula eletroquímica para produzir eletricidade também foi a Alessandro Volta italiana (1745-1827) em 1800 e, portanto, o nome alternativo da célula voltaica.
Partes da célula galvânica
As partes de uma célula galvânica são mostradas na Figura 1 e são as seguintes:
1.- Semi -media anódica
2.- Eletrodo de anódio
3.- Solução anódica
4.- Semi -media catódica
5.- Eletrodo catódico
6.- Solução catódica
7.- Ponte salina
8.- Condutor metálico
9.- Voltímetro
Funcionamento
Para explicar o funcionamento de uma célula galvânica, confiaremos no inferior:
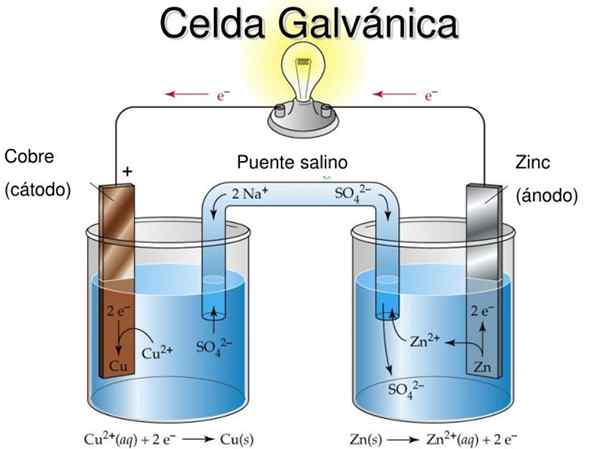 Figura 2. Modelo didático de células galvânicas. Fonte: Slideserve.com
Figura 2. Modelo didático de células galvânicas. Fonte: Slideserve.com A idéia fundamental de uma célula galvânica é que o metal sofrido pela reação de oxidação é fisicamente separado do metal que é reduzido, de modo que a troca de elétrons ocorre através de um condutor externo que permite aproveitar o fluxo da corrente elétrica , Por exemplo, para acender uma lâmpada ou LED.
Na Figura 2 na semi -media, à esquerda, você tem uma fita metálica de cobre (Cu) imersa em uma solução de sulfato de cobre (CUS04), Enquanto na semi -lídios certos, há uma fita de zinco (Zn) imersa em uma solução de sulfato de zinco (ZNSO4).
Deve -se notar que em cada semi -media o metal de cada um está presente em dois estados de oxidação: os átomos de metal neutro e os íons metálicos do sal do mesmo metal em solução.
Se as fitas metálicas não estiverem ligadas por um cabo condutor externo, os dois metais oxidam separadamente em suas respectivas células.
No entanto, quando estiver conectado eletricamente, a oxidação ocorrerá no Zn, enquanto haverá uma reação de redução no CU. Isso ocorre porque o grau de oxidação do zinco é maior que o de cobre.
O metal que oxida rende ao metal que é reduzido através do condutor externo e esse fluxo de corrente pode ser usado.
Pode atendê -lo: derivados halogenadosReações de oxidação e redução
A reação que ocorre no lado direito entre o eletrodo de metal de zinco e a solução aquosa de sulfato de zinco é a seguinte:
Znqualquer(S) + Zn2+ (SW4)2- → 2 Zn2+(AC) + (SW4)2- + 2 e-
Um átomo de zinco (sólido) na superfície do eletrodo anódico no semi -direito da direita, estimulado pelos íons positivos do zinco em solução, produz dois elétrons e emerge do eletrodo, indo para a solução aquosa como um íon duplo positivo de zinco.
Percebemos que o resultado líquido era que um átomo de zinco de metal neutro, perdendo dois elétrons, tornou -se um íon de zinco que aumenta a solução aquosa, de modo que a barra de zinco perdeu um átomo e a solução adquiriu um íon duplo positivo.
Os elétrons liberados preferem passar pelo cabo externo em direção ao metal da outra semi -media com carga positiva (Cartodo +). A barra de zinco está perdendo massa, uma vez que seus átomos passam gradualmente para a solução aquosa.
A oxidação de zinco pode ser resumida da seguinte forma:
Znqualquer(S) → Zn2+(AC) + 2 e-
A reação que ocorre no lado esquerdo é semelhante, mas o cobre da solução aquosa captura dois elétrons (provenientes da outra semi -tema) e é depositado no eletrodo de cobre. Quando um átomo captura elétrons, diz -se que é reduzido.
A reação de redução de cobre é escrita assim:
Cu2+(AC) + 2 e- → Cuqualquer(S)
A barra de cobre está ganhando massa, já que os íons da solução passam para o bar.
A oxidação ocorre no ânodo (negativo), que repele os elétrons, enquanto a redução ocorre no cátodo (positivo), que atrai elétrons. A troca de elétrons ocorre através do driver externo.
A ponte salina
A ponte salina equilibra as cargas que se acumulam nas duas semi -lies. Nos íons positivos semi -díados anódicos se acumulam, enquanto no catódico há um excesso de íons de sulfato negativo.
Para a ponte salina, é usada uma solução de sal (como cloreto de sódio ou cloreto de potássio) que não intervém na reação, que está em um tubo em forma de U invertido com suas extremidades conectadas com uma parede de material poroso.
O único objetivo da ponte salina é que os íons sejam filtrados para cada balanceamento de células ou neutralização do excesso de carga. Assim, através da ponte salina, há um fluxo de corrente, através dos íons salinos, que fecha o circuito elétrico.
Potenciais de oxidação e redução
Os potenciais de oxidação e redução padrão são entendidos.
Pode servir a você: Scandio: História, Propriedades, Reações, Riscos e UsosPara zinco, seu potencial de oxidação padrão éboi = +0,76 v. Enquanto isso, o potencial de redução padrão de cobre é egrade = +0,34 v. A força eletromotiva (FEM) produzida por esta célula galvânica é: FEM = +0,76 V + 0,34 V = 1,1 V.
A reação global da célula galvânica pode ser escrita assim:
Znqualquer(S) + Cu2+(AC) → Zn2+(AC) + Cuqualquer(S)
Tomando em consideração o sulfato, a reação líquida é:
Znqualquer(S) + Cu2+ (SW4)2- 25ºC → Zn2+ (SW4)2-+ Cuqualquer(S)
Sulfato é um espectador, enquanto os metais trocam elétrons.
Representação simbólica de uma célula galvânica
A célula galvânica da Figura 2 é simbolicamente representada da seguinte maneira:
Znqualquer(S)| Zn2+(AC) (1M) || Cu2+(AC) (1M) | Cuqualquer(S)
Por convenção, à esquerda o metal que oxida e forma o ânodo (-) e separado por uma barra (|) seu íon em estado aquoso é sempre colocado. O semi -medium anódico é separado do catódico por duas barras (||) que representa a ponte salina. À direita, o semi -medium de metal que é reduzido e forma o cátodo (+) é colocado.
Na representação simbólica de uma célula galvânica, o fim é sempre o metal que oxida e, no final, o metal é colocado (em estado sólido) que é reduzido. Deve -se notar que na Figura 2 os semicels estão ao contrário em relação à representação simbólica convencional.
Formulários
Conhecido o potencial de oxidação padrão de diferentes metais, é possível determinar a força eletromotiva que produzirá uma pilha galvânica construída com esses metais.
Nesta seção, o acima será aplicado nas seções anteriores para calcular a força eletromotora líquida de uma célula construída com outros metais.
Como exemplo de aplicação, consideramos uma célula de ferro galvânica (fé) e cobre (Cu). Como dados, são fornecidas as seguintes reações de redução e seu potencial de redução padrão, ou seja, a 25ºC e 1M de concentração:
Fé2+(AC) + 2 e- → Fé(S). E1grade = -0,44 v
Cu2+(AC) + 2 e- → Cu(S). E2grade = +0,34 v
É solicitado a encontrar a força eletromotora líquida produzida pela seguinte célula galvânica:
Fé(S)| Fé2+(AC)(1M) || Cu2+(AC)| Cu(S)
Nesta pilha, o ferro é oxidante e é o ânodo da célula galvânica, enquanto o cobre está sendo reduzido e é o cátodo. O potencial de oxidação do ferro é o mesmo, mas em oposição ao seu potencial de redução, isto é, e1Oxd = +0,44.
Para obter a força eletromotiva produzida por esta célula galvânica, adicionamos o potencial de oxidação de ferro ao potencial de redução de cobre:
Pode atendê -lo: óxidos de nitrogênio (NOX)FEM = E1Oxd + E2grade = -E1grade + E2grade = 0,44 V + 0,34 V = 0,78 V.
Célula galvânica na vida cotidiana
As células galvânicas para uso diário estão longe da forma usada como modelo didático, mas seu princípio de operação é o mesmo.
A célula de uso mais comum é a bateria alcalina de 1,5V em suas diferentes apresentações. O primeiro nome vem porque é um conjunto de células conectadas em série para aumentar o FEM.
As baterias recarregáveis de lítio também são baseadas no mesmo princípio de operação de células galvânicas e são aquelas usadas em smartphones, relógios e outros dispositivos.
Da mesma forma que as baterias principais de carros, motocicletas e barcos são 12V e são baseados no mesmo princípio de operação da célula galvânica.
As células galvânicas são usadas na estética e regeneração muscular. Existem tratamentos faciais que consistem na aplicação de corrente por dois eletrodos na forma de um rolo ou esfera que limpa e tonifica a pele.
Os pulsos atuais também se aplicam para regenerar a musculatura em pessoas que estão em um estado de prostração.
Construção de uma célula galvânica caseira
Existem muitas maneiras de construir uma célula galvânica caseira. Um dos mais simples é usar vinagre como solução, unhas de aço e cabos de cobre.
Materiais
-Vasos plásticos descartáveis
-Vinagre branco
-Dois parafusos de aço
-Dois pedaços de fio de cobre nu (sem isolamento ou verniz)
-Um voltímetro
Procedimento
-Encha ¾ partes do vidro com vinagre.
-Junte -se aos dois parafusos de aço com várias voltas de fio, deixando um pedaço de fio sem enrolamento.
A extremidade interminável do cabo de cobre é dobrada em uma forma de U invertida.
 Figura 3. Célula galvânica caseira e multímetro. Fonte: YouTube.com
Figura 3. Célula galvânica caseira e multímetro. Fonte: YouTube.com Outra parte do cabo de cobre também é dobrada em um invertido e pendurado na borda do vidro em posição diametralmente oposta aos parafusos submersos, de modo que uma porção do cobre fica dentro do vinagre e a outra porção do cabo de cobre na parte externa de o vidro.
As extremidades livres dos cabos de voltímetro são conectadas para medir a força eletromotiva produzida por esta célula simples. O FEM deste tipo de célula é 0,5V. Para combinar com o FEM de uma bateria alcalina, é necessário construir mais duas células e unir as três em série, para que uma bateria de 1,5V seja obtida
Referências
- Bornéu, r. Células galvânicas e eletrolíticas. Recuperado de: aulas Quimica.Blogspot.com
- Cedrón, J. Química Geral. PUCP. Recuperado de: Corinto.PUCP.Edu.educaçao Fisica
- Farrera, l. Introdução à eletroquímica. Departamento de Físico da UNAM. Recuperado de: DePa.Fquim.Unam.mx.
- Wikipedia. Célula eletroquímica. Recuperado de: é.Wikipedia.com.
- Wikipedia. Célula galvânica. Recuperado de: é.Wikipedia.com.

