Estrutura de acrilonitrila, propriedades, produção, usos

- 1436
- 426
- Melvin Mueller
Ele acrilonitrila É um composto orgânico cuja fórmula condensada é Cho2Chcn. É um dos nitrilos mais simples que existem. Química e estruturalmente, nada mais é do que o produto da união entre um grupo de vinil, CHO2= CH-, e um grupo de nitrila, cianeto, Ctal. É uma substância com grande impacto industrial no mundo dos plásticos.
Fisicamente, é um líquido incolor, com um certo cheiro de cebola, e que em estado impuro apresenta tons amarelados. É altamente inflamável, tóxico e possivelmente carcinogênico, por isso é classificado como uma substância extremamente perigosa. Ironicamente, com ele são fabricados plásticos e brinquedos da vida cotidiana, como Tupperware e Blocos Lego.
 Polímeros de acrilonitrila estão presentes no plástico Tupperware. Fonte: Stebulus via Wikipedia.
Polímeros de acrilonitrila estão presentes no plástico Tupperware. Fonte: Stebulus via Wikipedia. Em escalas industriais, acrilonitril. Quase toda a quantidade produzida é destinada à fabricação de plásticos, com base em homopolímeros, como poliacrilonitrila, ou em copolímeros, como o acrilonitrile-butadieno-estireno-estireno.
[TOC]
Estrutura de acrilonitrila
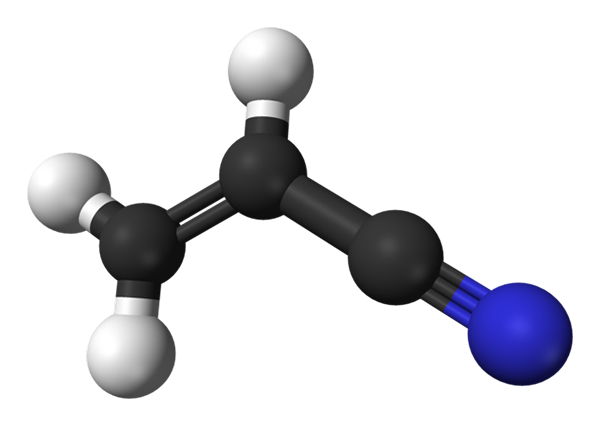 Estrutura molecular do acrilonitrila. Fonte: Benjah-BMM27 / Domínio Público
Estrutura molecular do acrilonitrila. Fonte: Benjah-BMM27 / Domínio Público Na imagem superior, temos a molécula de acrilonitrila representada com um modelo de esferas e barras. As esferas pretas correspondem a átomos de carbono, enquanto branco e azul para átomos de hidrogênio e nitrogênio, respectivamente. A esquerda, CH2= CH- corresponde ao grupo de vinil, e à direita, ao grupo ciano, Ctal.
Toda a molécula é plana, porque os carbonos do grupo de vinil têm hibridação de SP2. Enquanto isso, o grupo ciano carbono tem hibridação SP, estando ao lado do átomo de nitrogênio em uma linha que repousa no mesmo plano que o restante da molécula.
O grupo CN contribui com a polaridade para a molécula, então a molécula Cho2O CHCN estabelece um dipolo permanente onde a maior densidade eletrônica é direcionada para o átomo de nitrogênio. Portanto, dipolo-dipol.
Pode atendê -lo: o que é periodicidade química?As moléculas cap2O CHCN é plano, sendo capaz de esperar que, em seus cristais (solidificados em -84 ºC), eles estão disponíveis, como folhas ou folhas de papel, para que seus dipolos não se repelem.
Propriedades
Aparência física
Líquido incolor, mas com tons amarelados quando apresenta algumas impurezas. Quando assim, eles recomendam destilá -lo antes de seu uso. É volátil e também tem um cheiro intenso semelhante ao cebola.
Massa molar
53.064 g/mol
Ponto de fusão
-84 ºC
Ponto de ebulição
77 ºC
ponto de inflamação
-5 ºC (copo fechado)
0 ºC (copo aberto)
Temperatura de auto -dirigir
481 ºC
Densidade
0,81 g/cm3
Densidade do vapor
1.83 em relação aérea.
Pressão de vapor
109 mmHg a 25 ºC
Solubilidade
Na água, tem uma solubilidade de 74 g/L a 25 ºC. O acrilonitrila também é consideravelmente solúvel em acetona, petróleo, etanol, acetato de etila e benzeno etanile.
Decomposição
Quando libera termicamente o cianeto de hidrogênio tóxico, óxidos de carbono e óxidos de nitrogênio.
Produção
Processo Sohio
O acryonitrila pode ocorrer em escalas maciças através de inúmeras reações e processos químicos. De todos eles, o processo de Sohio é o mais usado, que consiste na ameaxidação catalítica do propileno. Em um reator de leito fluidizado, o propileno é misturado com ar e amônia a uma temperatura em torno de 400 e 510 ºC, onde reagem em catalisadores sólidos.
Os reagentes entram no reator uma vez, ocorrendo a seguinte reação:
2CH3−ch = ch2 + 2 NH3 + 3 o2 → 2 cap2= CH-C≡N + 6 h2QUALQUER
Observe que o oxigênio é reduzido à água, enquanto o propileno oxida o acrilonitrila. Daí o nome 'amoxidação', porque é uma oxidação que envolve a participação da amônia.
Pode atendê -lo: fervendo: conceito, tipos e exemplosProcessos alternativos
Além do processo Sohio, outras reações podem ser mencionadas que permitem a obtenção de acrilonitrila. Obviamente, nem todos eles são escaláveis, ou pelo menos de maneira lucrativa suficiente, nem geram produtos com alto desempenho ou pureza.
O acrilonitrila é sintetizado, novamente do propileno, mas fazê -lo reagir com óxido nítrico nos catalisadores PBO2-ZRO2 Airgel -em forma. A reação é a seguinte:
4 cap3−ch = ch2 + 6 não → 4 Cho2= CH-C≡N + 6 h2Ou + n2
Uma reação que não envolve propileno é a que começa com óxido de etileno, que reage com o cianeto de hidrogênio para se transformar em ciano -hidrina de etileno; E mais tarde, fica desidratado a uma temperatura de 200 ºC no acrilonitrila:
ETO + HCN → CH2Ohch2Cn
CH2Ohch2CN + Q (200 ºC) → CH2= CH-Ctaln +H2QUALQUER
Outra reação muito mais direta é a adição de cianeto de hidrogênio no acetileno:
Hc≡ch + hcn → ch2= CH-C bloco
No entanto, muitos produtos secundários são formados; portanto, a qualidade do acrilonitrila é menor em comparação com a do processo Sohio.
Além das substâncias acima mencionadas, lactonitrila, propionitril.
Formulários
 Legos são fabricados principalmente com plástico ABS, um copolímero em que o acrilonitrila é parte. Fonte: pxhere.
Legos são fabricados principalmente com plástico ABS, um copolímero em que o acrilonitrila é parte. Fonte: pxhere. Acrilonitrile é uma substância indispensável para a indústria de plásticos. Vários de seus plásticos derivados são altamente conhecidos. É o caso dos copolímeros acrilonitrilo-butadieno-estireno (ABS), com os quais as peças dos leigos são fabricados. Também temos fibras acrílicas, elaboradas com o homopolímero de poliacrilonitrila (PAN).
Pode atendê -lo: SaponificaçãoEntre outros plásticos que contêm acrilonitrila como monômero, ou que dependem dele para sua fabricação, temos: alongamento de acrileno (SAN), acrilonitrila butadieno (NBR), acrilato de acrilonitrila (ASA), poliacrilamida e borracha síntética e resinações de nitrílio e nitrílio.
Praticamente, qualquer polímero natural, como algodão, pode ser modificado incorporando suas estruturas moleculares ao acrilonitrila. Assim, são obtidos derivados de nitrila, o que torna a química do acrilonitrila muito amplo.
Um de seus usos fora do mundo dos plásticos é como pesticida misturada com tetracloreto de carbono. No entanto, devido ao seu terrível impacto no ecossistema marinho, esses pesticidas se proibiram ou estão sujeitos a fortes restrições.
Riscos
Acrilonitrila é uma substância perigosa, por isso deve ser manipulada com extremo cuidado. Qualquer exposição inadequada ou excessivamente prolongada a este composto pode ser letal, seja por inalação, ingestão ou contato físico.
Deve ser mantido o máximo possível de qualquer fonte de calor, pois é um líquido volátil e muito inflamável. Nem deveria estar em contato com a água, porque ele reage violentamente com ela.
Além disso, é uma substância possivelmente carcinogênica, que tem sido associada a câncer de fígado e pulmão. Aqueles que foram expostos a essa substância têm aumentos nos níveis de tiocianato excretados na urina e cianeto de sangue.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10ª edição.). Wiley Plus.
- Wikipedia. (2020). Acrilonitrila. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2020). Acrilonitrila. Banco de dados PubChem., CID = 7855. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Elsevier b.V. (2020). Acrilonitrila. Cientedirect. Recuperado de: ScientEdirect.com
- Korry Barnes. (2020). O que é acrilonitrila? - Uso e propriedades. Estudar. Recuperado de: estudo.com
- Pajonk, g.M., Manzalji, t. (1993). Síntese de acrilonitrila de propileno e misturas de óxido nítrico no PBO2-ZRO2 Catalisadores de Airgel. Catal Lett vinte e um, 361-369. doi.org/10.1007/BF00769488
- « Características de programação dinâmica, exemplo, vantagens, desvantagens
- O que é um processo isotérmico? (Exemplos, exercícios) »

