O que é um processo isotérmico? (Exemplos, exercícios)

- 2478
- 766
- Gilbert Franecki
Ele processo isotérmico ou isoterma é um processo termodinâmico reversível no qual a temperatura permanece constante. Em um gás, há situações nas quais uma mudança no sistema não produz variações de temperatura, mas em características físicas.
Essas mudanças são mudanças de fase, quando a substância muda de sólido para líquido, de fluido a gás ou vice -versa. Nesses casos, as moléculas de substância reajustam sua posição, adicionando ou extraindo energia térmica.
 figura 1. Os Carambans que derretem são um exemplo de processo isotérmico. Fonte: Pixabay.
figura 1. Os Carambans que derretem são um exemplo de processo isotérmico. Fonte: Pixabay. A energia térmica necessária para que uma mudança de fase ocorra em uma substância seja chamada de calor latente ou calor de transformação.
Uma maneira de obter um processo isotérmico é entrar em contato com a substância que será o sistema em estudo com um depósito térmico externo, que é outro grande sistema de capacidade calórica. Dessa forma, ocorre uma troca de calor tão lenta, que a temperatura permanece constante.
Esses tipos de processos são frequentemente dados na natureza. Por exemplo, em humanos quando a temperatura corporal aumenta ou desce, nos sentimos doentes, porque em nosso corpo numerosas reações químicas que mantêm a vida são dadas em temperatura constante. Isso é válido para sangue quente em geral.
Outros exemplos são o de gelo que derrete com calor quando os cubos de mola e gelo chegam.
[TOC]
Exemplos de processos isotérmicos
-O metabolismo dos animais de sangue quente é realizado a temperatura constante.
 Figura 2. Animais de sangue quente têm mecanismos para manter a temperatura constante. Fonte: Wikimedia Commons.
Figura 2. Animais de sangue quente têm mecanismos para manter a temperatura constante. Fonte: Wikimedia Commons. -Quando a água ferve uma mudança de fase, o fluido de gás, e a temperatura permanece constante a aproximadamente 100 º C, pois outros fatores podem influenciar o valor.
-O gelo que derrete é outro processo isotérmico frequente, além de colocar água no freezer para fazer cubos de gelo.
Pode atendê -lo: óptica geométrica: que estudos, leis, aplicações, exercícios-Motores de automóveis, geladeiras e muitos outros tipos de máquinas, operam corretamente em uma certa faixa de temperatura. Para manter a temperatura apropriada, os dispositivos chamados Termostatos. Em seu design, vários princípios operacionais são usados.
Ciclo de Carnot
Um motor Carnot é uma máquina ideal da qual o trabalho é obtido graças a processos totalmente reversíveis. É uma máquina ideal porque não considera processos que dissipam energia, como uma viscosidade da substância que faz o trabalho, nem atrito.
O ciclo de Carnot consiste em quatro estágios, dois dos quais são precisamente isotérmicos e os outros dois adiabáticos. Os estágios isotérmicos são compressão e expansão de um gás responsável por produzir o trabalho útil.
Um motor de carro opera com princípios semelhantes. O movimento de um pistão dentro do cilindro é transmitido a outras partes do carro e produz movimento. Ele não tem o comportamento de um sistema ideal como o motor Carnot, mas os princípios termodinâmicos são comuns.
Cálculo do trabalho realizado em um processo isotérmico
Para calcular o trabalho realizado por um sistema quando a temperatura é constante, a primeira lei da termodinâmica deve ser usada, o que afirma:
ΔU = Q - W
Essa é outra maneira de expressar a conservação de energia no sistema, apresentada através de ΔU ou mudança de energia, Q como o calor fornecido e finalmente C, qual é o trabalho realizado pelo referido sistema.
Suponha que o sistema em questão seja um gás ideal contido no cilindro de um pistão de área móvel PARA, O que funciona quando seu volume V mudança de V1 para V2.
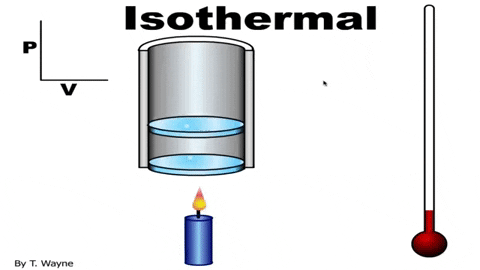 Figura 3. Em um processo isotérmico, o gás se expande no pistão sem alterar a temperatura. Fonte: YouTube.
Figura 3. Em um processo isotérmico, o gás se expande no pistão sem alterar a temperatura. Fonte: YouTube. A equação do status de gás ideal é PV = nrt, que relaciona o volume à pressão P e a temperatura T. Os valores de n e r são constantes: n é o número de moles do gás e a constante de gás. No caso de um processo isotérmico, o produto PV é constante.
Pode atendê -lo: Constantes Antoine: fórmulas, equações, exemplosBem, o trabalho realizado é calculado integrando um pequeno trabalho diferencial, no qual uma força F produz um pequeno deslocamento DX:
Dw = fdx = padx
Como ADX é precisamente a variação do volume Dv, então:
Dw = pdv
Para obter trabalho total em um processo isotérmico, a expressão de DW é integrada:
A pressão P e o volume V Eles são gráficos em um diagrama P-v Como o mostrado na figura e o trabalho realizado é equivalente à área sob a curva:
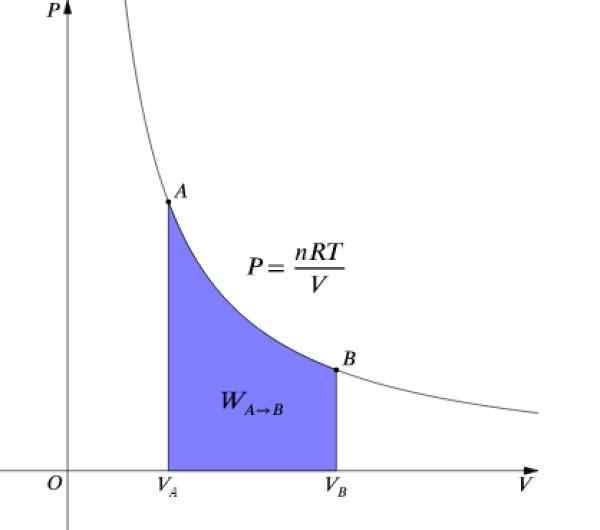 Figura 4. Diagrama de P-V de um processo isotérmico. Fonte: Wikimedia Commons.
Figura 4. Diagrama de P-V de um processo isotérmico. Fonte: Wikimedia Commons. Como ΔU = 0 Como a temperatura permanece constante, em um processo isotérmico, ele precisa:
Q = w
- Exercício 1
Um cilindro fornecido com um pistão móvel contém um gás ideal a 127 ºC. Se o pistão se mover até que o volume inicial seja reduzido 10 vezes, mantendo a temperatura constante, encontre a quantidade de moles contida no cilindro, se o trabalho realizado no gás for 38.180 J.
Facto: R = 8.3 J/mol. K
Solução
A declaração afirma que a temperatura permanece constante, então estamos na presença de um processo isotérmico. Para o trabalho realizado no gás, você tem a equação deduzida anteriormente:

127 º C = 127 + 273 K = 400 K
N claro, o número de toupeiras:
N = w / rt ln (v2 / v1) = -38180 j / 8.3 J/mol.K x 400 k x ln (V2/10V2) = 5 moles
Um sinal negativo era antes do trabalho. O leitor atencioso terá notado na seção anterior que W foi definido como "o trabalho realizado pelo sistema" e tem um sinal +. Portanto, o "trabalho realizado no sistema" tem um sinal negativo.
Pode servir a você: Segundo Equilíbrio Condição: Explicação, Exemplos, Exercícios- Exercício 2
Você tem ar em um cilindro fornecido com um punger. Inicialmente, existem 0.4 m3 de pressão a 100 kPa e 80 º C de temperatura. O ar está comprimido em 0.1 m3 Certifique -se de que a temperatura dentro do cilindro permaneça constante durante o processo.
Determinar quanto trabalho é feito durante este processo.
Solução
Utilizamos a equação para o trabalho anteriormente deduzido, mas o número de moles é desconhecido, que pode ser calculado com a equação dos gases ideais:
80 º C = 80 + 273 K = 353 K.
P1V1 = n.R.T → N = P1V1 /Rt = 100000 pa x 0.4 m3 /8.3 J/mol. K x 353 K = 13.65 mol
W = n.R.T ln (V2/V1) = 13.65 mol x 8.3 J/mol. K x 353 K x ln (0.1/0.4) = -55.442.26 J
Novamente, o sinal negativo indica que o trabalho foi realizado no sistema, o que sempre acontece quando o gás é compactado.
Referências
- Bauer, w. 2011. Física para engenharia e ciências. Volume 1. Mc Graw Hill.
- Cengel, e. 2012. Termodinâmica. 7MA Edição. McGraw Hill.
- Figueroa, d. (2005). Série: Física para Ciência e Engenharia. Volume 4. Fluidos e termodinâmica. Editado por Douglas Figueroa (USB).
- Cavaleiro, r. 2017. Física para cientistas e engenharia: uma abordagem de estratégia.
- Serway, r., Vulle, c. 2011. Fundamentos da Física. 9n / D Cengage Learning.
- Wikipedia. Processo isotérmico. Recuperado de: em.Wikipedia.org.
- « Estrutura de acrilonitrila, propriedades, produção, usos
- Frases consecutivas o que são e 75 exemplos »


