Óxido de enxofre
- 3198
- 401
- Lonnie MacGyver
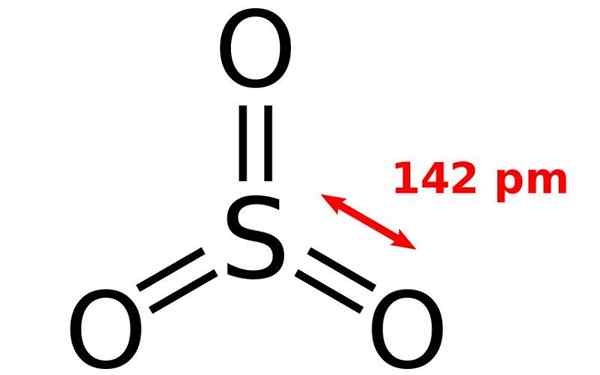
 Estrutura química da molécula de óxido de enxofre. Fonte: Joel Holdsworth, Wikimedia Commons
Estrutura química da molécula de óxido de enxofre. Fonte: Joel Holdsworth, Wikimedia Commons O que é óxido de enxofre?
Ele óxido de enxofre (Vi), também conhecido como enxofre ou trioxido de anidrido sulfúrico, é um composto químico de fórmula s3, Isso, em condições normais, é um sólido incolor e fibroso, e a 25 ° C e 1 atm é um poderoso agente poluente, responsável pela chuva ácida.
O trióxido de enxofre é produzido pela oxidação do oxidado de enxofre.
Até agora, no entanto, a única preparação pura de trióxido de enxofre a partir de gases contendo3 diluído, tem sido um processo em uma escala piloto que implica condensação criocópica.
O procedimento usual implica, em vez disso, destilação de petróleo. O calor necessário para a destilação de petróleo é fornecido de maneira mais conveniente por gás de contato quente da planta de ácido sulfúrico associado.
Pode ser preparado em laboratório aquecendo o ácido sulfúrico de fumantes e coletando sublimado em um receptor resfriado. Se o vapor for condensado acima de 27 ° C, a forma gama será obtida como um líquido.
Se o vapor for condensado abaixo de 27 ° C e na presença de uma linha de umidade, uma mistura das três formas é obtida. Os 3 formulários podem ser separados por destilação fracionada.
A queima de combustível fóssil é a causa de sua aparência na atmosfera, sendo esta a principal causa antropogênica.
Propriedades físicas e químicas do óxido de enxofre
- O trióxido de enxofre tem a forma de agulhas brancas que se tornam fumaça no ar. Você geralmente encontra inibidores para evitar a polimerização.
Pode atendê -lo: Renio: descoberta, propriedades, estrutura, usos- Seu peso molecular é de 80.066 g/mol, sua densidade é de 1,92 g/cm³ g/ml e os pontos de fusão e ebulição são 16,8 ° C e 44,7 ° C, respectivamente.
- O composto é combinado com água com força explosiva, formando ácido sulfúrico devido à sua acidez. Carboniza Sulphur Trioxide Organic Substâncias.
- O trióxido de enxofre absorve a umidade rapidamente, emitindo fumos brancos densos. As soluções de trióxido de ácido sulfúrico são chamadas de ácido sulfúrico ou óleo.
- A reação do trióxido de enxofre e o diffluoreto de oxigênio são muito vigorosos e as explosões são produzidas se a reação for realizada na ausência de um solvente.
- O excesso de reação de trióxido de enxofre com tetrafluoroetileno causa a decomposição explosiva de fluoreto de carbonil e dióxido de enxofre.
- A reação do ácido perclórico anidro com trióxido de enxofre é violento e é acompanhado pela evolução do calor considerável. O trióxido de enxofre líquido reage violentamente com cloreto de nitrila, até 75 ° C.
- A reação do trióxido de enxofre e o óxido de chumbo causam luminescência branca. A combinação de iodo, piridina, enxofre e trióxido de formamida desenvolveu um gás na pressurização após vários meses.
Isso se deve à lenta formação de ácido sulfúrico, água externa ou desidratação de formamida por cianeto de hidrogênio.
Riscos
O trióxido de enxofre é um composto estável, incompatível com materiais orgânicos, metais em pó, bases, água, cianetos e uma grande variedade de outros produtos químicos.
A substância é um oxidante forte e reage violentamente com materiais combustíveis e organizadores e compostos orgânicos que causam perigo de fogo e explosão.
Pode atendê -lo: oxalato de sódio (Na2C2O4): estrutura, propriedades, usos, riscosReage violentamente com água úmida e ar para produzir ácido sulfúrico. A solução na água é um ácido forte, reage violentamente com bases e metais corrosivos, formando gás inflamável / explosivo.
O composto é corrosivo para metais e tecidos. Causa queimaduras nos olhos e na pele. A ingestão causa queimaduras graves na boca, esôfago e estômago. O vapor é muito tóxico pela inalação.
Em caso de contato visual, você deve verificar se as lentes de contato estão sendo usadas e removê -las imediatamente. Os olhos devem ser lavados com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas. Água fria pode ser usada, sem aplicar a pomada dos olhos.
Se o produto químico entrar em contato com as roupas, retire -as o mais rápido possível, protegendo suas próprias mãos e corpo. Coloque a vítima sob um chuveiro de segurança.
Se o produto químico se acumular na pele exposta da vítima, como as mãos, a pele contaminada com água corrente e sabão não abrasivo é suavemente lavado e cuidadosamente. Água fria pode ser usada. Se a irritação persistir, procure atendimento médico. Lave roupas contaminadas antes de usá -las novamente.
Em caso de inalação, a vítima deve permanecer em uma área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível. Roupas apertadas soltas, como pescoço de camisa, cintos ou gravata.
Se a vítima é difícil de respirar, o oxigênio deve ser administrado. Se a vítima não está respirando, uma ressuscitação na boca é feita. Sempre levando em consideração que pode ser perigoso para a pessoa que fornece ajuda para dar a ressuscitação boca a boca quando o material inalado é tóxico, infeccioso ou corrosivo.
Pode atendê -lo: ácido pituitado (H3PO2): Propriedades, usos e reagentesEm todos os casos, deve -se procurar atenção médica imediata.
Por outro lado, a poluição do ar devido a óxidos de enxofre é um importante problema ambiental, com milhões de toneladas de dióxido de enxofre e trióxido emitidos à atmosfera todos os anos. Esses compostos são prejudiciais à vida vegetal e animal, bem como para muitos materiais de construção.
Outro grande problema a considerar é a chuva ácida. Ambos os óxidos de enxofre se dissolvem em gotas de água atmosférica para formar soluções ácidas, que podem ser muito prejudiciais quando caem na forma de chuva.
A chuva ácida pode danificar as florestas e fazer com que os peixes morram em muitos lagos. Também é corrosivo para metais, calcário e outros materiais. As possíveis soluções para esse problema são caras devido à dificuldade de eliminar o enxofre do carvão e do petróleo antes que eles queimem.
Formulários
- O trióxido de enxofre é um reagente essencial em reações de sulfonação. Esses processos fornecem detergentes, corantes e produtos farmacêuticos. É gerado in situ a partir de ácido sulfúrico ou usado como uma solução de ácido sulfúrico para fumar.
- Suas propriedades desinfetantes são responsáveis por séculos a serem usados para desinfetar os cubos de vinho, queimando enxofre dentro deles.
Referências
- Enxofre de trióxido. Recuperado de ebi.AC.Reino Unido
- Trioxido de enxofre de folha de dados de segurança do material. Recuperado do Sciencelab.com

