Átomo de carbono
- 2356
- 611
- Lonnie MacGyver
Explicamos o que é o átomo de carbono, sua estrutura eletrônica, características e hibridização orbital.
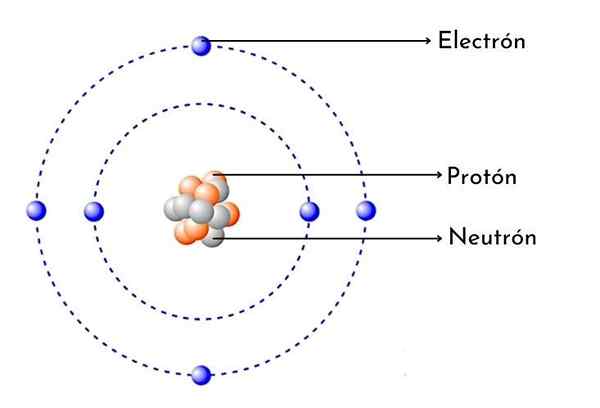
 Esquema de átomo de carbono
Esquema de átomo de carbono O que é átomo de carbono?
O carbono é o elemento número 6 da tabela periódica e é um dos elementos mais importantes que existem. Sua importância surge de uma química muito rica e variada que faz com que esse elemento forme o Base da vida no planeta Terra, como sabemos.
Trata-se de um metalóide pertencendo à Grupo 14 da tabela periódica (anteriormente Grupo 4A) e o segundo período. Em sua forma natural, está associado ao carvão (mineral e vegetal) e a fuligem, na qual é principalmente na forma de grafite ou outro alotope.
Ele Átomo de carbono Está entre os menores da tabela periódica. É um átomo tetravalente, ou seja, pode formar até quatro links com outros átomos iguais ou diferentes dos mesmos.
Carbono é de grande importância para os humanos. É um dos principais componentes do nosso corpo, formando mais de 19% de sua massa. Além disso, também possui várias aplicações tecnológicas derivadas de suas propriedades atômicas.
Características do átomo de carbono
- O átomo de carbono é não -metal: Carbono é um elemento não -metálico que pode ser combinado com muitos outros elementos da tabela periódica. Os átomos de carbono podem adquirir ou dar elétrons a outros átomos, tornando -se ânions ou cátions, respectivamente.
- Tem 6 prótons em seu núcleo: O número atômico de carbono é 6, o que significa que ele tem 6 prótons em seu núcleo. Isso também significa que um átomo de carbono neutro tem 6 elétrons ao redor do núcleo.
Pode atendê -lo: separação magnética- Pertence ao bloqueio P da tabela periódica: A configuração eletrônica de carbono em seu estado fundamental é 1s2 2s2 2 p2. Como pode ser visto, os últimos elétrons de Valência estão localizados em orbitais P, de modo que o carbono pertence ao bloco P da tabela periódica.
- As valências do átomo de carbono são +2, +4 e -4: A camada de valência do carbono está faltando apenas 4 elétrons para encher completamente e, assim, adquirir a configuração eletrônica do Noble Neon Gas. Por esse motivo, o carbono pode formar o ânion de carboneto, c4-, que tem 4 elétrons mais do que carbono neutro. Por outro lado, o átomo de carbono também pode perder os dois elétrons 2p, tornando -se o cátion de carbono (C2+), ou todos os 4 elétrons em Valência, tornando -se o cátion carbônico (c4+).
- Você pode formar vários ALOTROPES: O carbono elementar pode ser encontrado em duas formas naturais comuns que são grafite e diamante, que têm propriedades radicalmente opostas. Além disso, você pode formar caras diferentes, nanotubos de carbono e grafeno.
Os três isótopos do átomo de carbono
Todos os átomos de carbono têm seis prótons em seu núcleo, mas nem todos têm o mesmo número de nêutrons, dando origem a três isótopos:
- Carbon-12 (12C): É o mais estável e abundante (aproximadamente 98,9%). Tem 6 nêutrons em seu núcleo.
- Carbon-13 (13C): Tem 7 nêutrons.
- Carbon-14 (14C): É o uso radioativo do YS E para as datas de objetos antigos.
Estrutura eletrônica do átomo de carbono
Como todo átomo de carbono, possui seis prótons positivos em seu núcleo, então também tem 6 elétrons com carga negativa girando.
Pode atendê -lo: Aliquot (química)A maneira pela qual esses elétrons são distribuídos ou a configuração eletrônica do átomo de carbono é:
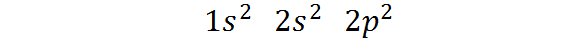
Esta configuração eletrônica indica que O carbono tem 2 elétrons no orbital 1S, Dois elétrons em 2s orbital, e Dois elétrons distribuídos entre os três orbitais 2p.
Por outro lado, a camada de valência para carbono é a camada L, que corresponde ao nível n = 2, pois é a camada de nível mais alta que contém elétrons. Como podemos ver, o carbono tem no total 4 elétrons no nível 2, Então dizemos isso Tem 4 elétrons de valência.
Esta é a razão pela qual o carbono está localizado no qual foi chamado anteriormente Grupo 4A da tabela periódica.
Hibridação orbital atômica no átomo de carbono
Átomos reagem e vinculam um ao outro através de seus elétrons de valência e os orbitais que ocupam. No entanto, estes últimos nem sempre têm orientação adequada para formar os links necessários.
A teoria do vínculo de Valencia afirma que os átomos misturam seus orbitais atômicos para formar novos orbitais híbridos que têm orientação adequada. Este processo é chamado Hibridação.
Dependendo do número de átomos aos quais um átomo de carbono está ligado, ele misturará ou hibridizará um número diferente de orbitais atômicos puros. Isso dá origem a Três hibridizações diferentes, que são:
Sp
Ocorre quando o carbono está ligado apenas a Dois átomos. Nesse caso, o orbital s com um dos três orbitais P é misturado, dando origem a dois orbitais de SP que apontam em direções opostas (180º um do outro).
Pode atendê -lo: Mercury BarômetroOs dois orbitais p que são deixados sem mistura são usados para formar ligações PI. O átomo de carbono pode formar Um link triplo (que contém duas ligações PI) com um único átomo ou pode formar Dois links duplos, um com cada átomo (e com um link pi cada).
Sp2
Quando o carbono quer se juntar Três átomos, Você precisa de três orbitais híbridos, então misture três orbitais puros: os orbitais e dois orbitais p. Isso gera três orbitais híbridos SP2 Isso aponta para os cantos de um triângulo equiláteis.
O Orbital P que não foi usado pode formar um link PI com qualquer um dos três átomos vinculados, dando origem a uma ligação dupla.
Sp3
Quando o carbono vai se vincular a Quatro átomos, Misture os 4 orbitais puros da sua camada de valência para gerar 4 sp orbital híbrido3. Estes apontam para os vértices de um tetraedro comum.
Como não há orbitais para formar ligações PI, um carbono com hibridação SP3 Você só pode formar quatro links simples e nenhum link múltiplo.
Referências
- Britannica, os editores da Encyclopaedia. Carbono - fatos, usos e propriedades. Retirado de https: // www.Britannica.com/ciência/elementos de carbono-químico
- Laboratório de Monitoramento Global. (s. F.). Gases de estufa de ciclo de carbono. Retirado de https: // gml.NOAA.Gov/ccg/isótopes/química.Html

