Estrutura de desidrogenase succinato, função, regulação, doenças
- 2200
- 492
- Lonnie MacGyver
SUccinato desidrogenase (Sdh), também conhecido como complexo II da cadeia de transporte de elétrons, é um complexo de proteínas mitocondriais com atividade enzimática que funciona tanto no ciclo de Krebs quanto na cadeia transportadora de elétrons (respiração celular).
É uma enzima presente em todas as células aeróbicas. Nos eucariotos, é um complexo intimamente associado à membrana mitocondrial interna, enquanto nos procariontes é encontrado na membrana plasmática.
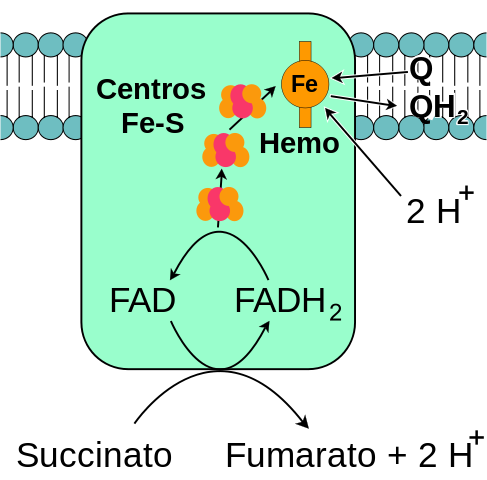 Esquema geral do complexo mitocondrial succinato desidrogenase (fonte: eu mesmo, com base na vetorização de fvasconcellos. / Domínio público, via Wikimedia Commons)
Esquema geral do complexo mitocondrial succinato desidrogenase (fonte: eu mesmo, com base na vetorização de fvasconcellos. / Domínio público, via Wikimedia Commons) O complexo succinato desidrogenase, descoberto por volta de 1910 e purificado pela primeira vez em 1954 por Singer e Kearney, foi extensivamente estudado por vários motivos:
- Funciona no ciclo Krebs (ciclo do ácido cítrico ou ciclo de ácido tricarboxílico) e na cadeia de transporte de elétrons (catalisa a oxidação do succinato ao fumarato)
- Sua atividade é regulada por diferentes ativadores e inibidores e
- É um complexo associado a: ferro não está ligado a um grupo Hemo, Labyl Sulphur e Dyucleotides of Flavina Adenina (FAD)
É codificado pelo genoma nuclear e ficou provado que mutações nos quatro genes que codificam cada uma de suas subunidades (a, b, c e d) resultam em várias imagens clínicas, ou seja, elas podem ser bastante negativas a partir do ponto de visão da integridade física dos seres humanos.
[TOC]
Estrutura
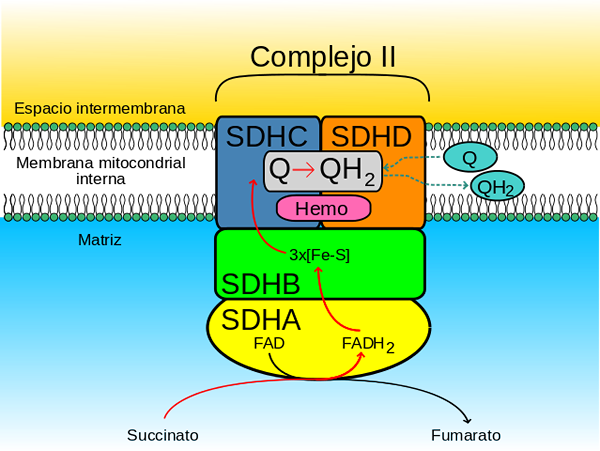
O complexo enzimático succinato desidrogenase é formado por quatro subunidades (heterotarámero) codificadas pelo genoma nuclear, por isso é o único complexo de fosforilação oxidativa na cadeia transportadora de elétrons que não possui qualquer subunidade codificada pelo genoma mitocôndor.
Além disso, este complexo é o único que não bombeia prótons através da membrana mitocondrial interna durante sua ação catalítica.
De acordo com estudos baseados no complexo enzimático de células cardíacas suínas, o complexo succinato desidrogenase consiste em:
- a "cabeça" Hidrofílico que se estende da membrana mitocondrial interna à matriz mitocondrial e
- a "linha" Hidrofóbico que está incorporado na membrana mitocondrial interna e que possui um pequeno segmento projetado para o espaço intermembranar solúvel das mitocôndrias
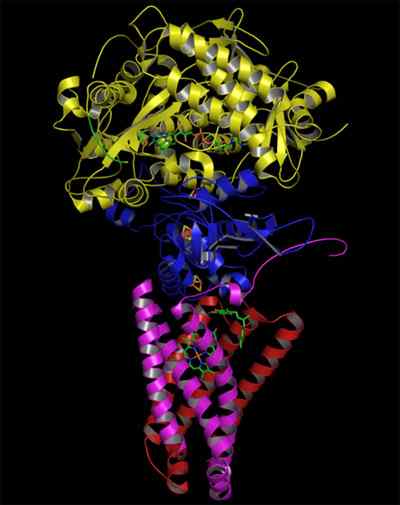
 Estrutura da complexa desidrogenase de succinato complexa (Fonte: Zephyris na Wikipedia da língua inglesa/CC BY-SA (http: // criativeCommons.Org/licenças/BY-SA/3.0/) via Wikimedia Commons)
Estrutura da complexa desidrogenase de succinato complexa (Fonte: Zephyris na Wikipedia da língua inglesa/CC BY-SA (http: // criativeCommons.Org/licenças/BY-SA/3.0/) via Wikimedia Commons) Estrutura da porção hidrofílica
A cabeça hidrofílica é composta pelo SDHA (70 kDa) e SDHB (27 kDa) (Sdh1 e Sdh2 em leveduras) e isso compreende o centro catalítico do complexo.
As subunidades SDHA e SDHB contêm cofatores redox que participam da transferência de elétrons para a ubiquinona (coenzima Q10, uma molécula que transporta elétrons entre os complexos respiratórios I, II e III).
A subunidade SDHA possui um cofator de moda (uma coenzima que participa de reações de redução de óxido) junto com sua estrutura, apenas no local da junção para succinato (o substrato principal da enzima).
A subunidade SDHB possui 3 centros de açúcar de ferro (Fe-S) que mediam a transferência de elétrons para a ubiquinona. Um dos centros, 2Fe-2s, fica perto do local da moda da subunidade SDHA e os outros (4FE-4s e 3Fe-4s) são adjacentes ao primeiro.
Pode atendê -lo: filogeniaDeve -se notar que os estudos estruturais indicam que a subunidade SDHB forma a interface entre o domínio catalítico hidrofílico e o domínio de "âncora" à membrana (hidrofóbica) do complexo.
Estrutura de porção hidrofóbica
O domínio membranal do complexo, como afirmado, consiste no SDHC (15 kDa) e SDHD (12-13 kDa) (Sdh3 e Sdh4 em leveduras), que são proteínas de membrana abrangentes formadas, cada uma, por 3 transmissões transmembranares formadas.
Este domínio contém uma porção Hemo b juntou -se na interface entre as subunidades SDHC e SDHD, onde cada um dos dois ligantes da histidina que os mantêm juntos.
Nesta enzima, dois locais da União para Ubiquinona foram detectados: um de grande afinidade e um de baixa afinidade.
O site de alta afinidade, conhecido como QP (P por proximal) É face à matriz mitocondrial e é formado por resíduos específicos de aminoácidos localizados nas subunidades SDHB, SDHC e SDHD.
O site de baixa afinidade, também chamado QD (D por distal) É, na parte da membrana mitocondrial interna, onde o complexo é inserido, mais próximo do espaço intermembranar, ou seja, mais longe da matriz de organelas.
Juntos, o complexo total tem um peso molecular próximo a 200 kDa e foi determinado que possui uma proporção de 4.2-5.0 nanomoles de flavina por miligrama de proteína e 2-4 g de ferro para cada mol de flavina.
Função
O complexo de succinato enzimático desidrogenase cumpre uma função importante nas mitocôndrias, como não apenas participa do ciclo de Krebs (onde participa da degradação de acetil -CoA), mas também parte da cadeia respiratória, fundamental para a produção de energia ATP -Shaped.
Em outras palavras, é uma enzima chave para metabolismo intermediário e produção aeróbica ATP.
- É responsável pela oxidação do succinato ao fumarato no ciclo do ácido cítrico
- Alimenta o complexo III da cadeia transportadora de elétrons com os elétrons derivados da oxidação do succinato, o que ajuda a reduzir o oxigênio e formar água
- O transporte de elétrons gera um gradiente eletroquímico através da membrana mitocondrial interna, que favorece a síntese de ATP
Como alternativa, os elétrons podem ser usados para reduzir as moléculas de uma “piscina” ubiquinonas, produzindo os redutores necessários para reduzir os ânions de superóxido que se originam da mesma cadeia respiratória ou que vêm de fontes exógenas.
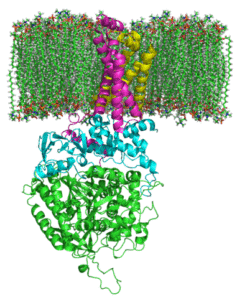
 Succinate Complex Degidrogenasa (Fonte: JohnHFST / Public Domin, via Wikimedia Commons)
Succinate Complex Degidrogenasa (Fonte: JohnHFST / Public Domin, via Wikimedia Commons) Como isso age?
A subunidade A do complexo (que está covalentemente ligada à coenzima da moda) se une aos substratos, fumarato e succinato, bem como seus reguladores fisiológicos, oxalacetato (inibidor competitivo) e ATP.
O ATP desloca a união entre o oxalacetato e o complexo SDH e, então, os elétrons que são "passados" do succinato para a subunidade SDHA são transferidos para os grupos de átomos de ferro e enxofre presentes na subunidade SDHB por meio da coenzima FAD.
Pode atendê -lo: miosina: características, estrutura, tipos e funçãoDa subunidade B, esses elétrons atingem os locais Hemo b Das subunidades SDHC e SDHD, de onde são "entregues" para Quinonas Coenzimas através de seus sites de sindicatos para Quinonas.
O fluxo eletrônico do succinato através desses transportadores e até o aceitador final, que é oxigênio, é acoplado à síntese de 1.5 moléculas de ATP para cada torque eletrônico através da fosforilação da cadeia respiratória.
Defeitos de Inzima
Foi relatado que mutações no gene que codifica a subunidade a da complexa succinato desidrogenase podem causar encefalopatias durante a infância, enquanto isso as mutações nos genes que codificam subunidades b, c e d foram associados à formação de tumores.
Regulamento
A atividade da complexa succinato desidrogenase pode ser regulada por modificações pós -tradução como o fosforilação e a acetilação, Embora a inibição do site ativo também possa ocorrer.
A acetilação de algum desperdício de lisina pode diminuir a atividade dessa enzima e esse processo é realizado por uma enzima de acetilase conhecida como SIRT3; A fosforilação tem o mesmo efeito na enzima.
Além dessas modificações, o complexo SDH também é regulado por intermediários do ciclo Krebs, especificamente o Oxalacetato e ele sucinada. O oxalacetato é um inibidor poderoso, enquanto o succinato favorece a dissociação do oxalacetato, funcionando como ativador.
Deficiência de impulcinar desidrogenase
A deficiência de succinato desidrogenase é uma anomalia ou transtorno da cadeia respiratória mitocondrial. Essa deficiência é causada por sdha (ou sdhaf1), sdhb, sdhc e sdhd mutações.
Diferentes investigações demonstraram mutações homozigotas e heterozigotas nesses genes, especialmente SDHA. As mutações desses genes causam substituições de aminoácidos na proteína (em qualquer um dos sdha, b, c ou d), ou falhando que codificam proteínas anormalmente curtas.
Portanto, substituições de aminoácidos e codificação de proteína anormalmente curta dão origem a distúrbios ou alterações da enzima SDH, que causam uma falha na capacidade ideal das mitocôndrias de produzir energia. É isso que os cientistas chamam de distúrbio da cadeia respiratória mitocondrial.
Este distúrbio pode ser expresso no ser humano fenotipicamente de várias maneiras. Os mais conhecidos são: deficiência ou falta de desenvolvimento linguístico, quadruplex espástico, contrações involuntárias musculares (distonia), fraqueza muscular e miocardiopatia, entre outros problemas relacionados.
Alguns pacientes com desidrogenase de deficiência de succinato podem manifestar a doença de Leight ou a síndrome de Kearns-Saire.
Como a deficiência de succinato desidrogenada é detectada?
Certos estudos sugerem o uso de testes e análises qualitativas, bem como análise bioquímica quantitativa, enzimática e de cadeia respiratória. Outros, por outro lado, sugerem a expansão completa pela reação em cadeia da polimerase (PCR) dos exons das subunidades em estudo e depois, o respectivo sequenciamento.
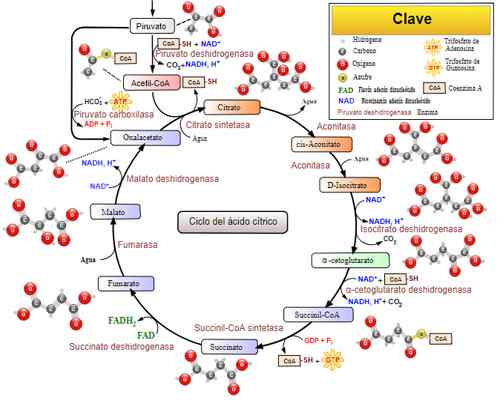 Ciclo de ácido tricarboxílico (ciclo Krebs). Tomado e editado de: Narayanese, Wikiuserpedia, Yassinemrabet, TotoBaggins (traduzido para o espanhol por Alejandro Porto) [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)].
Ciclo de ácido tricarboxílico (ciclo Krebs). Tomado e editado de: Narayanese, Wikiuserpedia, Yassinemrabet, TotoBaggins (traduzido para o espanhol por Alejandro Porto) [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Doenças relacionadas
Existem muitas expressões fenotípicas produzidas por distúrbios da cadeia respiratória mitocondrial, devido à succinar deficiência desidrogenase. No entanto, quando se trata de síndromes ou doenças, se fala do seguinte.
Pode atendê -lo: os 8 ciclos biogeoquímicos mais importantes (descrição)Síndrome de Leight
É uma doença neurológica progressiva, associada a mutações no genoma nuclear (neste caso de succinato de desidrogenase), que afetam o complexo de piruvato-dishidrogenase à via de fosforilação oxidativa.
Os sintomas aparecem antes do primeiro ano do indivíduo, mas em casos atípicos, os primeiros sintomas durante a adolescência foram observados.
Entre os sintomas mais comumente observados estão: hipotonia com perda de controle cefálico, movimentos involuntários, vômitos recorrentes, problemas respiratórios, incapacidade de mover as células sanguíneas oculares, pirâmide e sinais extrapiramida. Convulsões não são muito comuns.
É possível que a doença possa ser detectada em diagnósticos pré -natais. Uma cura ou tratamento específico não é conhecido, mas alguns especialistas sugerem tratamentos com certos vitaminas ou cofatores.
Tumor de estroma gastrointestinal (GIST)
Comumente chamado GIST, é um tipo de tumor do trato gastrointestinal, que geralmente se desenvolve em áreas como estômago ou intestino delgado. Acredita -se que a causa destes seja devida a um certo grupo de células altamente especializadas chamadas células ICC ou células intersticiais de Cajal.
Outras considerações sobre a causa da GIST são as mutações de certos tipos de genes, que, de acordo com alguns autores, causam 90% dos tumores. Os genes envolvidos são: kit, genes pdgfra, desidrogenase succinato (sdh) - pobre.
A succinato desidrogenase (SDH) - pobre, ocorre principalmente em mulheres jovens, produz tumores estomacais e com frequência relativa produz metástases em linfonodos. Uma pequena porcentagem ocorre em crianças e, na maioria dos casos, é devido à falta de expressão da subunidade SDHB.
Síndrome de Kearns-Sayre
Foi determinado que alguns pacientes com succinato desidrogenase deficiências podem manifestar a síndrome de Kearns-Sayre. Esta doença está relacionada a distúrbios mitocondriais e é caracterizada pela ausência de movimento de balões oculares.
Outras características desta doença são retinite pigmentar, surdez, cardiomiopatia e condições centrais do sistema nervoso. Normalmente, esses sintomas são observados antes que o paciente gire 20 anos. Nenhum diagnóstico pré -natal para esta condição é conhecido.
Nem a cura para esta doença. O tratamento é paliativo, ou seja, só funciona para reduzir os efeitos da doença, não a cura. Por outro lado, embora dependa do número de órgãos afetados e dos cuidados médicos recebidos, a expectativa de vida é relativamente normal.
Referências
- Ackrell, b. PARA., Kearney, e. B., & Singer, T. P. (1978). [47] succinato de mamíferos desidrogenase. Em métodos em enzimologia (vol. 53, pp. 466-483). Academic Press.
- Brère, J. J., Favier, J., Ghouzzi, v. E., Djoudi, f., Benit, p., Gimenez, a. P., & Rustin, P. (2005). Déficicina de succinato desidrogenase em humano. CELULAR E MOLECULAR LIFE SCIENCS CMLS, 62 (19-20), 2317-2324.
- Cecchini, g., Schröder, i., Gunalus, r. P., & Maklashina, e. (2002). Succinato desidrogenase e fumerar a redatase de Escherichia coli. Biochimica et Biophysica Acta (BBA) -Bioenergetics, 1553 (1-2), 140-157.
- Hatefi, e., & Davis, K. PARA. (1971). Succinate desidrogenase. Yo. Purificação, propriedades moleculares e subestrutura. Bioquímica, 10 (13), 2509-2516.
- Hederstedt, l. PARA. R. S., & Rutberg, l. PARA. R. S. (1981). Succinate desidrogenase-A revisão comparativa. Revisões Microbiológicas, 45 (4), 542.
- Nelson, d. eu., Lehninger, a. eu., & Cox, M. M. (2008). Lehninger Principles of Biochemistry. Macmillan.
- Rutter, j., Winge, d. R., & Schiffman, J. D. (2010). Succinate desidrogenase-Asmbléia, regulamentação e papel no DIEW humano. MithoCondrion, 10 (4), 393-401.
- « Funções essenciais de ácidos graxos, importância, nomenclatura, exemplos
- Recursos da regra T, para que serve, exemplos »

