Componentes de solução hipotônica, preparação, exemplos
- 2887
- 357
- Melvin Mueller
A Solução hipotônica É aquele que apresenta uma concentração de soluto menor em relação a uma solução separada ou isolada por um bug semipermeável. Essa barreira permite que o solvente transtenha, a água no caso de sistemas biológicos, mas nem todas as partículas de soluto.
Os fluidos corporais de vertebrados intracelulares e extracelulares têm uma osmolaridade de cerca de 300 Mosm/L. Embora se considere que um líquido hipotônico tem uma osmolaridade menor que 280 Mosm/L. Portanto, uma solução dessa osmolaridade é hipotônica em relação ao meio celular.
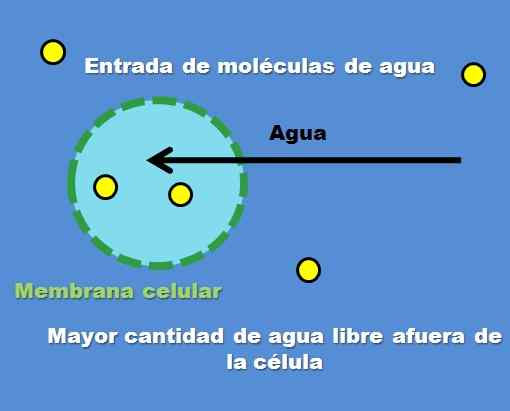
 Interação de uma célula com uma solução hipotônica. Fonte: Gabriel Bolívar.
Interação de uma célula com uma solução hipotônica. Fonte: Gabriel Bolívar. Um exemplo de solução hipotônica é 0,45% de cloreto de sódio. Mas como a célula ou compartimento se comporta na frente desse tipo de solução? A imagem superior responde a esta pergunta.
A concentração de partículas de soluto (pontos amarelos) é maior dentro da célula externa. Tendo menos soluto ao redor da célula, há mais moléculas de água livres, por isso é representado com uma cor azul mais intensa em comparação com o interior da célula.
A água flui para fora através da osmose para nivelar concentrações. Como resultado, a célula se expande ou ventilador absorvendo água que atravessa sua membrana celular.
[TOC]
Componentes de soluções hipotônicas
As soluções hipotônicas consistem em um solvente que, a menos que indicado de outra forma, consiste em água, e solutos dissolvidos nele, como sais, açúcares, etc., em forma pura ou mista. Mas essa solução não terá tonicidade se não houver barreira semipermeável, que se torna a membrana celular.
Pode servir a você: nitrato de cálcio (CA (NO3) 2)Deve haver poucos sais dissolvidos para que sua concentração seja pequena, enquanto a "concentração" da água é alta. Tendo mais água livre fora da célula, ou seja, não está resolvendo ou hidratando partículas de soluto, maior a sua pressão na membrana celular e mais tenderá a cruzá -la para diluir o fluido intracelular.
Preparação de uma solução hipotônica
Para a preparação dessas soluções, o mesmo protocolo é seguido como o seguido para outras soluções. Os cálculos apropriados da massa dos solutos são feitos. Em seguida, estes são pesados, dissolver -se na água e levar uma bandeira compartilhada com o volume que corresponde a ele.
A solução hipotônica tem baixa osmolaridade, geralmente menos de 280 Mosm/L. Portanto, ao preparar uma solução hipotônica, devemos calcular sua osmolaridade de tal maneira que seu valor é menor que 280 Mosm/L. A osmolaridade pode ser calculada com a seguinte equação:
Osmolaridade = m · v · g
Onde m É a molaridade do soluto, e v O número de partículas nas quais um composto é dissociado em solução. Substâncias não eletrolíticas não se dissociam, portanto o valor de V é igual a 1. Este é o caso de glicose e outros açúcares.
Enquanto g é o coeficiente osmótico. Este é um fator de correção para a interação de partículas eletricamente carregadas (íons) em solução. Para soluções diluídas e substâncias não dis -dissociadas, por exemplo e novamente glicose, um valor de g igual a 1 é tomado. Dizem então que o molaridade é idêntico à sua osmolaridade.
Exemplo 1
Prepare uma solução de cloreto de sódio (NaCl) a 0,5 % (p/v) verificando se é ou não uma solução hipotônica. Peso molecular de NaCl = 58,5 g/mol.
A solução de NaCl de 0,5 % é transportada por litro:
Pode atendê -lo: peróxido de cálcio (CaO2): propriedades, riscos e usosNaCl em g/l = (0,5 g ÷ 100 ml) · 1.000 ml
= 5 g/l
E continuamos a calcular sua molaridade e depois determinamos sua osmolaridade:
Molaridade = Massa (G/L) ÷ Peso Molecular (G/Mol)
= 5 g/l ÷ 58,5 g/mol
= 0,085 moles/L
NaCl se dissocia em duas partículas: na+ (cátion) e cl- (ânion). Então o valor de v = 2. Além disso, como é uma solução de NaCl a 0,5 %diluída, pode -se assumir que o valor de g (coeficiente osmótico) é 1. Temos então:
Osmolaridade (NaCl) = molaridade · v · g
= 0,085 m · 2 · 1
= 0,170 OSM/L O 170 MOSM/L
Esta é uma solução hipotônica, uma vez que sua osmolaridade é muito menor que a osmolaridade de referência para fluidos corporais que são osmolaridades plasmáticas cujo valor é em torno de 300 Mosm/L l.
Exemplo 2
Prepare uma solução de uma mistura de cloreto de cálcio (CACL2) a 0,055 % (p/v) e glicose (C6H12QUALQUER6) em 4 % (P/V). Pesos moleculares: CACL2 = 111 g/mol e c6H12QUALQUER6 = 180 g/mol.
Calculamos a molaridade com as concentrações dos respectivos solutos a 0,55 g/L e 40 g/L:
Molaridade (CACL2) = 0,55 g/l ÷ 111 g/mol
= 4,95 · 10-3 M
= 4,95 mm
Molaridade (c6H12QUALQUER6) = 40 g/l ÷ 180 g/mol
= 0,222 m
= 222 mm
E da mesma maneira que calculamos as asmolaridades, sabendo que o clique2 Ele se dissocia em três íons, dois cl- E um ca2+, e assumindo que eles são soluções muito diluídas, então o valor de v É 1. Nós temos:
Osmolaridade (CACL2) = 4,95 mm · 3 · 1
= 14,85 Mosm/L
Osmolaridade de (c6H12QUALQUER6) = 222 mm · 1 · 1
= 222 Mosm/L
Finalmente, a osmolaridade total da solução se torna a soma de asmolaridades individuais; isto é, dos de NaCl e glicose. Este é, portanto:
Pode atendê -lo: materiais refratáriosOsmolaridade total da solução = osmolaridade CACL2 + osmolaridade c6H12QUALQUER6
= 222 Mosm/L + 14,85 Mosm/L
= 236,85 Mosm/L
A solução da mistura de cloreto de cálcio e glicose é hipotônica, uma vez que sua osmolaridade (236,85 Mosm/L) é muito menor que a osmolaridade plasmática (300 Mosm/L), que é tomada como referência.
Exemplos de soluções hipotônicas
Solução de cloreto de sódio
A solução de cloreto de sódio a 0,45 % é administrada por via intravenosa a pacientes com cetose diabética que desenvolvem desidratação em compartimentos intersticiais e intracelulares. A água flui do plasma para esses compartimentos.
Solução de lactato de campainha
Ringer Lactate Solution No. 19 é outro exemplo de solução hipotônica. Sua composição é de 0,6 g de cloreto de sódio, 0,03 g de cloreto de potássio, 0,02 g de cloreto de cálcio, 0,31 g de lactato de sódio e 100 ml de água destilada. É uma solução usada para a reidratação do paciente e é ligeiramente hipotônica (274 Mosm/L).
Referências
- De Lehr Spilva, para. E Muktans, e. (1999). Guia para especialidades farmacêuticas na Venezuela. XXXVª Edição. Edições globais.
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Wikipedia. (2020). Tonicidade. Recuperado de: em.Wikipedia.org
- Union Media LLC. (2020). Soluções isotônicas, hipotônicas e hipertônicas. Recuperado de: UnionTestPrep.com
- Lodish H, Berk A, Zipursky SL, et al. (2000). Seção 15.8osmose, canais de água e a regulação do volume celular. NCBI Bookshelf. Recuperado de: NCBI.Nlm.NIH.Gov
- John Brennan. (13 de março de 2018). Como calcular a isotonicidade. Recuperado de: cienting.com
- « Matilde Hidalgo de Prince Biografia, Contribuições e Obras
- As 15 características mais importantes do teatro »

