Sais orgânicos
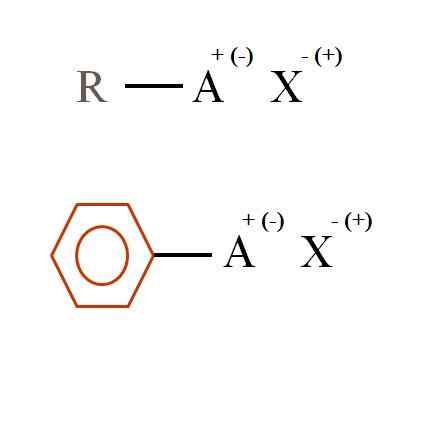
- 2439
- 610
- Melvin Mueller
 Duas fórmulas químicas gerais para sais orgânicos. Fonte: Gabriel Bolívar
Duas fórmulas químicas gerais para sais orgânicos. Fonte: Gabriel Bolívar O que são sais orgânicos?
As Sais orgânicos Eles são um número denso de compostos iônicos com inúmeras características. Anteriormente derivado de um composto orgânico, que passou por uma transformação que lhe permite ser uma carga e que sua identidade química depende do íon associado.
Na imagem superior, duas fórmulas químicas muito gerais são mostradas para sais orgânicos. O primeiro, R-Ax, é interpretado como um composto em cuja estrutura de carbono um átomo, ou grupo A, usa uma carga + positiva ou negativa (-).
Como pode ser visto, há uma ligação covalente entre R e A, R-A, mas, por sua vez, tem uma carga formal que atrai (ou repele) para o íon x. O sinal de carga dependerá da natureza de A e do ambiente químico.
Se fosse positivo, quantos X poderiam interagir? Com um, dado o princípio da eletroneutralidade (+1-1 = 0). No entanto, qual é a identidade de x? Ânion x pode ser o CO32-, exigindo dois cátions ra+; Uma halogenídeo: f-, Cl-, Br-, etc.; ou mesmo outro composto-. As opções são incalculáveis.
Da mesma forma, um sal orgânico pode ser aromático, ilustrado no anel marrom benzênico. Sal de benzoato de cobre (ii), (c6H5COO)2Cu, por exemplo, consiste em dois anéis aromáticos com grupos carboxy carregados negativamente, que interagem com o cátion Cu2+.
Propriedades físicas e químicas de sais orgânicos
A partir da imagem, pode -se afirmar que os sais orgânicos consistem em três componentes: o orgânico, r ou ar (o anel aromático), um portador de átomo ou grupo da carga iônica a e um contra -morto x x.
Assim como a identidade e estrutura química são definidas por esses componentes, da mesma maneira que suas propriedades dependem deles.
A partir desse fato, certas propriedades gerais que atendem à grande maioria desses sais podem ser resumidas.
Pode servir a você: Número de oxidação: conceito, como divulgá -lo e exemplosMassas moleculares com alto teor
Assumindo ânions inorgânicos mono ou versáteis, os sais orgânicos geralmente têm massas moleculares muito maiores do que os sais inorgânicos. Isso se deve principalmente ao esqueleto carbonatado, cujas ligações C-C simples, e seus átomos de hidrogênio, proporcionam muita massa ao composto.
Portanto, eles são os responsáveis por suas massas moleculares altas.
Anfifílico e surfactantes
Os sais orgânicos são compostos anfifílicos, ou seja, suas estruturas têm extremos hidrofílicos e hidrofóbicos.
O que são tais extremos? R ou AR representam a extremidade hidrofóbica, porque seus átomos de C e H não têm grande afinidade por moléculas de água.
PARA+(-), O grupo de portadores de átomo ou carga é a extremidade hidrofílica, uma vez que contribui para o momento dipolar e interage com o dipolo formador de água (RA+ Oh2).
Quando as regiões hidrofílicas e hidrofóbicas são polarizadas, o sal anfifílico se torna um surfactante, uma substância amplamente utilizada para a elaboração de detergentes e não azul -azerto.
Altos pontos de ebulição ou fusão
Como sais inorgânicos, os sais orgânicos também apresentam altos pontos de fusão e ebulição, devido às forças eletrostáticas que governam em fase líquida ou sólida.
No entanto, tendo um componente orgânico R ou AR, outros tipos de van der Waals (Londres, Dipolo-Dipolo, Bridges de hidrogênio) participam de alguma forma com a eletrostática.
Por esse motivo, as estruturas sólidas ou líquidas de sais orgânicos são, em primeira instância, mais complexos e variados. Alguns deles podem até se comportar como cristais líquidos.
Acidez e basicidade
Os sais orgânicos geralmente são ácidos ou bases mais fortes do que os sais inorgânicos. Isso ocorre porque, por exemplo, em sais de amina, ele tem uma carga positiva devido ao seu vínculo com um hidrogênio adicional: a+-H. Em seguida, em contato com uma base, doe o próton para ser um composto neutro novamente:
Pode servir a você: estrôncio: história, estrutura, propriedades, reações e usosRa+H + b => ra + hb
O H pertence a A, mas está escrito, pois intervém na reação de neutralização.
Por outro lado, ra+ Pode ser uma molécula grande, incapaz de formar sólidos com uma rede cristalina estável com ânion hidroxil ou oxidrilo oh-.
Quando é assim, o sal de sal+Oh- Ele se comporta como uma base forte; Mesmo tão básico quanto Naoh ou Koh:
Ra+Oh- + Hcl => racl + h2QUALQUER
Observe na equação química que o ânion cl- substitua oh-, formando o sal ra+Cl-.
Usos de sais orgânicos
O uso de sais orgânicos varia de acordo com a identidade de r, ar, a e x. Além disso, a aplicação a que eles são alocados também depende do tipo de sólido ou líquido que formam. Algumas generalidades a esse respeito são:
- Eles servem como reagentes para a síntese de outros compostos orgânicos. Rax pode atuar como um "doador" da cadeia R para adicionar a outro composto substituindo um bom grupo de saída.
- Eles são surfactantes, para que também possam ser usados como lubrificantes. Os sais de carboxilalato de metal são usados para esse fim.
- Eles permitem sintetizar uma ampla gama de corantes.
Exemplos de sais orgânicos
Carboxilatos
Os ácidos carboxílicos reagem com um hidróxido em uma reação de neutralização, causando sais de carboxilalato: rcoo- M+; onde m+ Pode ser qualquer cátion metálico (na+, PB2+, K+, etc.) ou o cátion de amônio4+.
Os ácidos graxos são de ácidos carboxílicos longos de cadeia, eles podem ser saturados e insaturados. O ácido palmítico está entre os saturados (escolha3(CH2)14COOH). Isso origina o sal do palmitato, enquanto o ácido esteárico (CHO3(CH2)16COOH forma o sal de Stear. Soaps são constituídos desses sais.
Pode atendê -lo: Lei Geral de GásNo caso de ácido benzóico, C6H5COOH (onde C6H5- É um anel de benzeno), quando reage com uma base forma os sais do benzoato. Em todos os carboxilatos o grupo -co- Representa um (Rax).
Lítio diabilcupratos
O dia do lítio é útil na síntese orgânica. Sua fórmula é [R-Cu-R]-Li+, em que o átomo de cobre carrega uma carga negativa. Aqui, o cobre representa o átomo da imagem.
Sais de sulfônio
Eles são formados a partir da reação de um sulfeto orgânico com halogenídeo alquil:
R2S + r'x => r2R's+X
Para esses sais, o átomo de enxofre carrega uma carga formal positiva (s+) ter três links covalentes.
Sais de Oxyio
Da mesma forma, os éteres (os análogos oxigenados dos sulfetos) reagem com os hidraceídeos para formar as salas de oxi:
Ror ' + hbr ro+HR ' + BR-
O próton do ácido hbr está consistentemente ligado ao átomo de oxigênio éter (r2QUALQUER+-H), cobrando positivamente.
Sais de Amina
Aminas podem ser primárias, secundárias, terciárias ou quaternárias, assim como seus sais. Todos eles são caracterizados por ter um átomo de h ligado ao átomo de nitrogênio.
Assim, Rnh3+X- É um sal de amina primária; R2NH2+X-, de Amina secundária; R3NH+X-, de amina terciária; e r4N+X-, de amina quaternária (sal de amônio quaternário).
Sais de diazônio
Finalmente, sais de diazônio (RN2+X-ou Arildiazonium (RNA2+X-), eles representam o ponto de partida de muitos compostos orgânicos, especialmente os corantes azóicos.
Referências
- Francis a. Tortoisshell. Química orgânica (sexta edição, pp. 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. Química orgânica. Aminas (10ª edição.). Wiley Plus.
- Wikipedia (2018). Sal (química). Retirado de: em.Wikipedia.org
- Steven a. Hardinger (2017). Glossário ilustrado da química orgânica: sais. Recuperado de: química.UCLA.Edu
- Chevron Oronite (2011). Carboxilatos. [PDF]. Recuperado de: Oronite.com

