Rádio atômico
- 2325
- 333
- Lonnie MacGyver
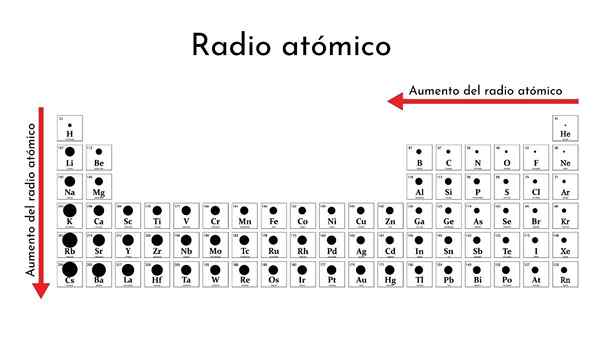
 Tabela periódica dos elementos com rádios atômicos
Tabela periódica dos elementos com rádios atômicos Qual é o rádio atômico?
Ele rádio atômico É um parâmetro importante para as propriedades periódicas dos elementos da tabela periódica. Está diretamente relacionado ao tamanho dos átomos, uma vez que o rádio maior, maior ou volumoso. Da mesma forma, está relacionado às características eletrônicas do mesmo.
Enquanto um átomo tem mais elétrons, quanto maior seu tamanho atômico e rádio. Ambos são definidos pelos elétrons da camada de Valência, porque a distâncias além de suas órbitas, a probabilidade de encontrar um elétron está se aproximando de zero. O oposto ocorre nas proximidades do núcleo: a probabilidade de encontrar um elétron é aumentada.
 Pacote de bola de algodão. A maneira como eles são compactados define seu tamanho e rádios, da mesma maneira que acontece com átomos
Pacote de bola de algodão. A maneira como eles são compactados define seu tamanho e rádios, da mesma maneira que acontece com átomos A imagem superior representa uma embalagem de bola de algodão. Observe que cada um está cercado por seis vizinhos, sem contar outra linha possível ou inferior. A maneira pela qual as bolas de algodão são compactadas definirá seus tamanhos e, portanto, seus rádios; Como nos átomos.
Os elementos de acordo com sua natureza química interagem com seus próprios átomos de uma maneira ou de outra. Portanto, a magnitude do raio atômico varia de acordo com o tipo de ligação presente e com a embalagem sólida de seus átomos.
Como o raio atômico é medido?
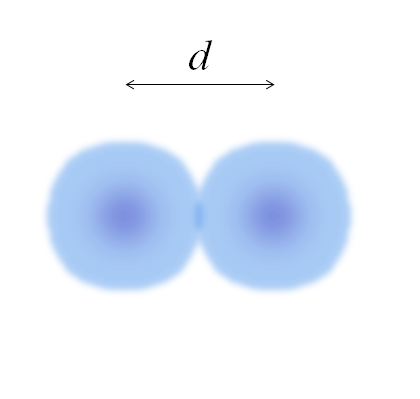 Imagem de dois átomos, cujas bordas não estão totalmente definidas. Fonte: Gabriel Bolívar
Imagem de dois átomos, cujas bordas não estão totalmente definidas. Fonte: Gabriel Bolívar Na imagem anterior, pode ser simples. No entanto, a esfera de um átomo não está totalmente definida. Porque? Porque os elétrons circulam e borrados em regiões de concreto de espaço: orbitais.
Portanto, o átomo pode ser considerado como uma esfera com bordas impalpáveis, o que é impossível dizer com certeza onde eles terminam. Por exemplo, na imagem superior, a região do centro, perto do núcleo, parece uma cor mais intensa, enquanto suas bordas estão borradas.
Pode atendê -lo: solvationA imagem representa uma molécula diatômica e2 (Como o CL2, H2, QUALQUER2, etc.). Assumindo que os átomos são corpos esféricos, se a distância fosse determinada d Isso separa os dois núcleos no elo covalente, seria suficiente dividi -lo em duas metades (d/2) obter o raio atômico; mais precisamente, o raio covalente de e para e2.
E se E não formasse títulos covalentes consigo mesmo, mas era um elemento metálico? Então d Seria indicado pelo número de vizinhos em torno de E em sua estrutura metálica; isto é, pelo número de coordenação (n.C) do átomo dentro da embalagem (lembre -se das bolas de algodão da imagem).
Determinação da distância internuclear
Para determinar d, que é a distância internuclear para dois átomos em uma molécula ou embalagem, são necessárias técnicas de análise física.
Um dos mais utilizados é a difração de raios X. Irradia um feixe de luz através de um vidro, e o padrão de difração resultante das interações entre elétrons e radiação eletromagnética é estudada.
Dependendo da embalagem, diferentes padrões de difração podem ser obtidos e, portanto, outros valores de d.
Se os átomos forem "apertados" na rede cristalina, eles apresentarão diferentes valores de d em comparação com aqueles que teriam se estivessem "confortáveis".
Da mesma forma, essas distâncias internucleares podem variar de valores, de modo que o raio atômico realmente consiste em um valor médio de tais medições.
Como o raio atômico e o número de coordenação se relacionam? V. Goldschmidt estabeleceu uma relação entre os dois, na qual para um n.C de 12, o valor relativo é 1; de 0.97 para embalagens onde o átomo tem n.C igual a 8; de 0.96, para um n.C igual a 6; e 0.88 para um n.C de 4.
Pode atendê -lo: permanganato de sódio (namno4): propriedades, riscosUnidades
Dos valores para n.C igual a 12, muitas das tabelas foram construídas onde os rádios atômicos de todos os elementos da tabela periódica são comparados.
Como nem todos os elementos formam essas estruturas compactas (n.C menor que 12), a proporção V é usada. Goldschmidt para calcular seus rádios atômicos e expressá -los para a mesma embalagem. Dessa maneira, as medições dos rádios atômicos são padronizados.
Mas quais unidades são expressas em? Dado que d É de magnitude muito pequena, as unidades do angstrom Å (10 ∙ 10-10m) ou também amplamente utilizado, o picômetro (10 ∙ 10-12m).
Como você muda na tabela periódica?
Por um período
Os rádios atômicos determinados para elementos metálicos são chamados rádios metálicos, enquanto para aqueles elementos não -metálicos, rádios covalentes (como fósforo, p4, ou enxofre, S8). No entanto, entre os dois tipos de rádios, há uma distinção mais proeminente do que o nome.
Da esquerda para a direita no mesmo período, o núcleo adiciona prótons e elétrons, mas os últimos estão confinados ao mesmo nível de energia (número quântico principal).
Como conseqüência, o núcleo exerce uma crescente carga nuclear eficaz em elétrons de valência, que contrai o raio atômico.
Dessa maneira, elementos não -metálicos no mesmo período tendem a ter rádios atômicos (covalentes) menores.
Descendo por um grupo
Ao descer por um grupo, novos níveis de energia estão sendo ativados, o que permite que os elétrons tenham mais espaço. Assim, a nuvem eletrônica cobre maiores distâncias, sua periferia embaçada acaba mais do núcleo e, portanto, o raio atômico se expande.
Pode atendê -lo: grupo hidroxilaContração de Lantanide
Os elétrons da camada interna ajudam a brilhar a carga nuclear efetiva nos elétrons de valência. Quando os orbitais que compõem as camadas internas têm muitas “cavilhas” (nós), como nos orbitais, o núcleo contrai fortemente o raio atômico devido ao pobre efeito de escudo deles.
Este fato é evidenciado na contração de Lantanide no período 6 da tabela periódica. Do HF, há uma contração considerável do produto do raio atômico dos orbitais f, que são “preenchidos” como o bloco F: o dos lantanoides e actinóides são percorridos.
Um efeito semelhante também pode ser observado com os elementos do Bloco P do período 4. Desta vez, o produto do fraco efeito de blindagem dos orbitais d que são preenchidos viajando os períodos de metais de transição.
Exemplos de rádios atômicos
Para o período 2 da tabela periódica, os rádios atômicos de seus elementos são:
-Li: 257 pm
-BE: 112 pm
-B: 88 pm
-C: 77 pm
-N: 74 pm
-O: 66 pm
-F: 64 pm
Observe que o metal de lítio possui o maior raio atômico (257 pm), enquanto a flúor, localizada na extremidade direita do período, é a menor de todos (64 pm). O raio atômico desce da esquerda para a direita no mesmo período, e os valores da listagem mostram.
Lítio, formando ligações metálicas, seu raio é metálico; e fluoreto, como forma de ligação covalente (F-F), seu raio é covalente.
E se você quiser expressar rádios atômicos em unidades angstrom? Será suficiente para dividi -los por 100: (257/100) = 2.57å. E assim por diante com o resto dos valores.
Referências
- Química 301. Radii atômico. Recuperado de: CH301.cm.Utexas.Edu
- Fundação CK-12 (2016). Raio atômico. Recuperado de: química.Librettexts.org
- Tendências em raios atômicos. Retirado de: Introdução.Chem.OKSTATE.Edu
- Clackamas Community College (2002). Tamanho atômico. Recuperado de: DL.Clackamas.Edu
- Clark J. (2012). Raio atômico e iônico. Recuperado de: Chemguide.co.Reino Unido
- Shiver & Atkins. (2008). Química Inorgânica (Quarta Edição, p. 23, 24, 80, 169). Mc Graw Hill.

