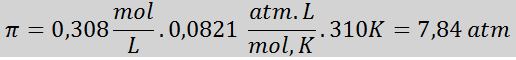Propriedades coligativas de soluções
- 2029
- 126
- Terrell Stokes
O que são propriedades coligativas?
As Propriedades coligativas, Também chamados de propriedades coletivas de soluções, elas são um grupo de quatro propriedades que dependem apenas da quantidade de partículas presentes na solução, mas não na natureza dessas partículas.
Em outras palavras, essas propriedades surgem da presença de partículas que não sejam do solvente, ou seja, partículas do soluto, mas não dependem de quem é o soluto. Qualquer tipo de partícula pode dar origem a propriedades coligativas, não importa se são átomos, íons ou moléculas. A única coisa que importa é a sua concentração.
As propriedades coligativas são quatro:
- Decisão da pressão do vapor do solvente
- Elevação de Ebullloscópica
- Descendência crioscópica
- Pressão osmótica
Todos são caracterizados por serem proporcionais à concentração do soluto no caso de soluções relativamente diluídas (concentração <0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
Vamos ver cada uma dessas quatro propriedades em detalhes:
1. Decisão da pressão do vapor do solvente
Quando uma solução de soluto não volátil é preparada, a pressão de vapor da solução resultante é sempre menor que a pressão de vapor do solvente puro. Em outras palavras, dissolver um soluto não volátil em um solvente, causa uma diminuição na pressão de vapor do referido solvente, em comparação com o solvente puro.
Fórmula de diminuição da pressão do vapor
Como todas as propriedades coligativas, a diminuição da pressão do vapor (DP) é proporcional à concentração do soluto. Combinando a lei de Raault com as equações de fração molar, pode -se demonstrar que o DP é dado por:
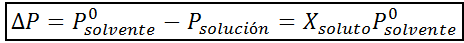
onde p °solvente representa a pressão de vapor do solvente puro a uma determinada temperatura, psolução corresponde à pressão de vapor da solução e xsoluto representa a concentração do soluto expressa como fração molar.
Por que diminui a pressão do vapor com o soluto?
A força que impulsiona os processos mais naturais, como a evaporação de um solvente, é o aumento da entropia ou nível de desordem. Quando um líquido evapora, ele vai de um estado muito ordenado (no líquido) para um muito confuso (em gás), pois na fase gasosa há muito mais liberdade de movimento.
Pode atendê -lo: Violet GlassNo entanto, em uma solução, a presença do soluto adiciona desordem à fase líquida, sem afetar a fase gasosa (uma vez que o soluto não evapora).
Por esse motivo, a diferença no nível de desordem entre a solução e a fase gasosa é menor do que entre o solvente puro e a fase gasosa; portanto, o solvente tem menos evaporar no segundo caso.
Exemplo
Problema: Sabendo que a pressão do vapor da água a uma certa temperatura é de 30,55 mmHg, determine a pressão de vapor de uma solução preparada dissolvendo 7,20 gramas de glicose (massa molar ou mm = 180g/mol) em 360 g de água (mm = 18,0 g/mol) na mesma temperatura.
Solução: Nesse caso, a fração molar do soluto deve ser calculada primeiro. Já temos todos os dados necessários para isso:
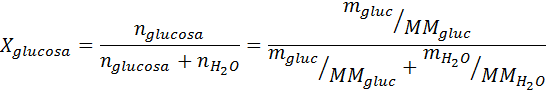
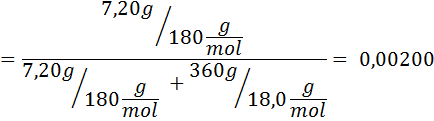
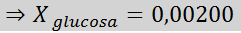
Então a equação da diminuição da pressão do vapor é aplicada.
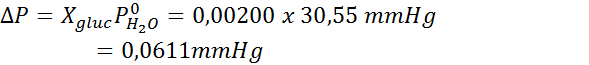
Agora determinamos a nova pressão de vapor do solvente:
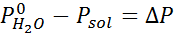
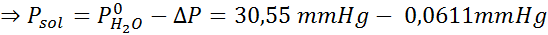
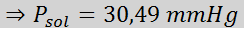
2. Ebullloscópica de elevação ou ponto de ebulição
Elevação de Ebullloscópica refere -se ao aumento no ponto de ebulição de uma solução em comparação com o ponto de ebulição do solvente puro. Para entender por que isso acontece, lembre -se de que o ponto de ebulição é definido como a temperatura na qual a pressão de vapor de um líquido é feita igual à pressão atmosférica.
Como as soluções têm uma pressão de vapor menor que o solvente puro (como acabamos de ver na seção anterior), é necessário aquecê -lo mais para poder alcançar a pressão atmosférica e, assim, atingir seu ponto de ebulição. Por esse motivo, o ponto de ebulição das soluções (com solutos não voláteis) é sempre maior que o do solvente puro.
Fórmula de elevação de Ebullloscópica
O aumento do ponto de ebulição (dtb) É proporcional à concentração do soluto expresso na molalidade, conforme indicado pela seguinte equação:
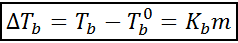
Onde tb É o ponto de ebulição da solução, tb° é o ponto de ebulição do solvente puro, kb É a constante de Ebullloscópica do solvente e m É a molalidade do soluto.
Exemplo
Problema: Sabendo que a constante de água fervente é de 0,52 ° C.kg/mol, determine o ponto de ebulição da solução de glicose preparada no exemplo anterior.
Solução: Para determinar a elevação de Ebullloscópica, precisamos apenas de moralidade.
Pode atendê -lo: óxido de lata (ii): estrutura, propriedades, nomenclatura, usos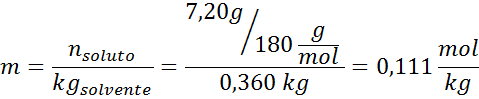
Agora aplicamos a fórmula DTb:
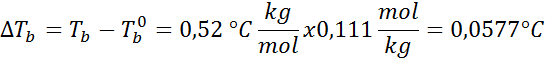
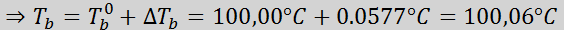
3. Descendência crioscópica
A diminuição crioscópica é a diminuição no ponto de congelamento de uma solução em comparação com o ponto de congelamento do solvente puro. A razão pela qual isso acontece é semelhante ao aumento de Ebullloscópico e tem sua origem na diminuição da pressão do vapor.
Esta propriedade é amplamente usada em clima frio, onde neva no inverno. Nesses países, é muito comum ver caminhões espalhando sais como NACL ou CACL2 em estradas ou em bancos públicos, após o que a neve derrete. A razão pela qual derrete é que o sal diminui o ponto de congelamento da água.
Fórmula de Descendência Crioscópica
A equação de descida criroscópica é muito semelhante à do aumento de Ebullloscópica. Também é proporcional à concentração moral e depende, neste caso, de uma constante crioscópica do solvente.
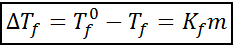
onde tF É o ponto de congelamento da solução, tF° é o ponto de congelamento do solvente puro, kF É a constante criroscópica do solvente e m É a molalidade do soluto.
Exemplo
Problema: Sabendo que a constante de água crioscópica é 1,86 ° C.kg/mol, determine o ponto de congelamento da solução de glicose preparada no exemplo anterior.
Solução: A moralidade da solução já estava determinada, para que possamos determinar diretamente DTF Usando a fórmula anterior:
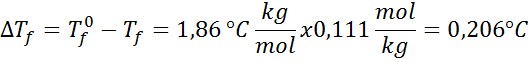
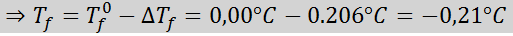
4. Pressão osmótica
Osmose é um processo de grande importância no nível químico e biológico. Isso consiste no fluxo de moléculas de solvente (por exemplo, água) de uma solução diluída para outra solução mais concentrada quando são separadas por meio de uma membrana semipermeável (que apenas permite que o solvente passe, mas não o soluto).
Essa tendência de "absorver" o solvente através de uma membrana semipermeável é uma propriedade que depende apenas da concentração total de partículas de soluto presentes na solução, independentemente do soluto. Por esse motivo, essa tendência é uma propriedade coligativa e é medida através da pressão osmótica.
A pressão osmótica (π) é a pressão que deve ser aplicada a uma solução para parar a osmose. Quanto maior a pressão osmótica, mais tendência a solução de absorver o solvente (ou, mais precisamente, mais tendência o solvente para se espalhar em direção a essa solução) tem a solução).
Pode atendê -lo: magnésio: história, estrutura, propriedades, reações, usosPor que a osmose ocorre?
A explicação por trás do processo de osmose é muito simples. Todas as substâncias tendem a se espalhar de onde estão mais concentradas onde são mais diluídas. Isso é instruído a seguir seu gradiente de concentração.
Quando uma solução está mais concentrada no soluto, ao mesmo tempo é mais diluído em solvente e vice -versa. Por esse motivo, o solvente tem uma tendência natural de passar da solução mais diluída (onde o solvente está mais concentrado) em direção à solução mais concentrada (onde é mais diluído).
Fórmula de pressão osmótica
A pressão osmótica pode ser calculada com uma fórmula muito semelhante à equação de gases ideais:
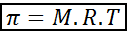
Nesta equação, π é a pressão osmótica, m é a concentração molar do soluto, r é a constante universal dos gases ideais (0,0821 atm.L/mol.K) e t é a temperatura absoluta em k.
Pressão osmótica e tonicidade
A pressão osmótica é muito importante para o funcionamento do corpo humano. De fato, as soluções salinas que são injetadas por via intravenosa são classificadas de acordo com se sua pressão osmótica é maior, igual ou menor que a do plasma sanguíneo ao que é chamado de tonicidade.
- Uma solução menos concentrada de que o plasma tem uma pressão osmótica mais baixa e é informado Solução hipotônica.
- Se você tem a mesma concentração total de solutos, é informado solução isotônica.
- Se você tem uma maior pressão osmótica (ou concentração), é informado solução hipertônica.
Exemplo
Problema: Calcule a pressão osmótica a 310 K de uma solução salina a 0,9% (m/v), que é isotônica com plasma sanguíneo.
Solução: Já temos a temperatura, então a única coisa que falta é determinar a concentração molar das partículas de sal (NaCl) na solução. Por esta.
Cada 100 ml de solução contém 0,9 g de NaCl, então:
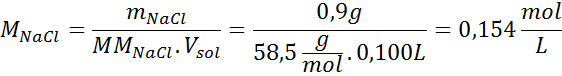
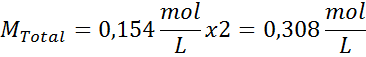
Essa é a concentração total de partículas de soluto na solução, para que agora possamos calcular a pressão osmótica: