Forças intermoleculares
- 3458
- 646
- Melvin Mueller
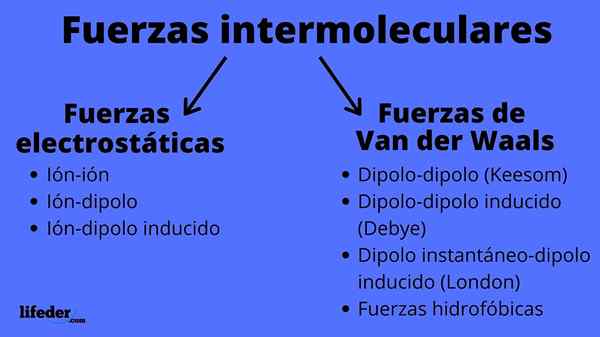
 Esquema de tipos de forças intermoleculares
Esquema de tipos de forças intermoleculares O que são forças intermoleculares?
As Forças intermoleculares Eles são um conjunto de interações que ocorrem entre as moléculas, seja do mesmo composto químico ou não, e que os mantêm juntos. Graças a essas forças, as moléculas conseguem agrupar e definir um sólido, líquido ou gás; isto é, eles são responsáveis pelas propriedades físicas das substâncias.
As forças intermoleculares podem ser de dois tipos: eletrostático ou van der Waals. Os eletrostáticos são todos aqueles em que temos íons, que são átomos ou moléculas carregadas eletricamente (+ ou -). Enquanto isso, os de van der Waals envolvem átomos ou moléculas neutras, que por flutuações em sua distribuição eletrônica são polarizadas e atraídas ou repelidas entre si.
As forças intermoleculares podem ser comparadas à união existente entre diferentes peças de leigos. Dependendo de suas formas e diretrizes, seus sindicatos se tornam mais fracos ou mais fracos, assim como eles mudam o design e as dimensões finais da construção.
Quanto mais fortes essas forças são, mais difícil será separar as peças dos leigos ou, no caso da química, as moléculas. Isso também significa que haverá maior compactação e, portanto, as moléculas definirão mais líquidos viscosos, gases mais pesados ou mais densos.
Outras propriedades físicas, como fusão e pontos de ebulição, volatilidade, textura, etc., Eles também são reflexos macroscópicos das forças intermoleculares que governam entre as moléculas ou íons de um composto ou misturas. Por exemplo: as forças intermoleculares dos gases são muito fracas em comparação com as de uma pedra.
Entender forças intermoleculares é essencial para descrever muitos dos conceitos químicos, físicos e biológicos.
Forças eletrostáticas
Íons de íons
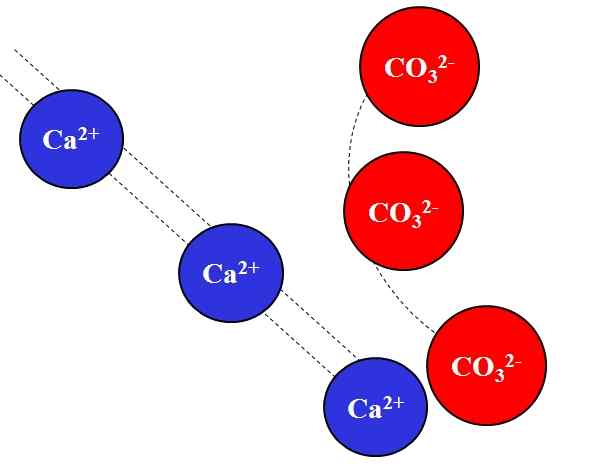 Atração eletrostática entre íons Ca2+ e Co32-. Fonte: Gabriel Bolívar.
Atração eletrostática entre íons Ca2+ e Co32-. Fonte: Gabriel Bolívar. Os íons de cargas opostos atraem com grande força, que se deve à lei de Coulomb e diminui rapidamente quanto mais os íons se afastam.
Por exemplo, o ca on2+ É uma carga positiva, um cátion, enquanto o CO32- É um íon de carga negativo, um ânion. Sendo suas cargas opostas, CA2+ e companhia32- Eles se atraem, evidenciando que quanto mais próximos eles estão, mais juntos eles permanecerão.
Pelo contrário, íons com a mesma carga, positivos ou negativos, repelem com a mesma força, mas no sentido oposto. Assim, o CA2+ Repelindo em íons como na+, Mg2+, K+, etc., A menos que haja outros ânions que diminuam a repulsa.
Pode atendê -lo: dibenzalacetona: propriedades, mecanismo de reação, usos, riscosDe todas as forças intermoleculares, as do tipo de íons de íons são as mais simples; Mas, ao mesmo tempo, o mais forte de todos. É necessária muita energia ou calor para separar os íons.
Ion-dipolo
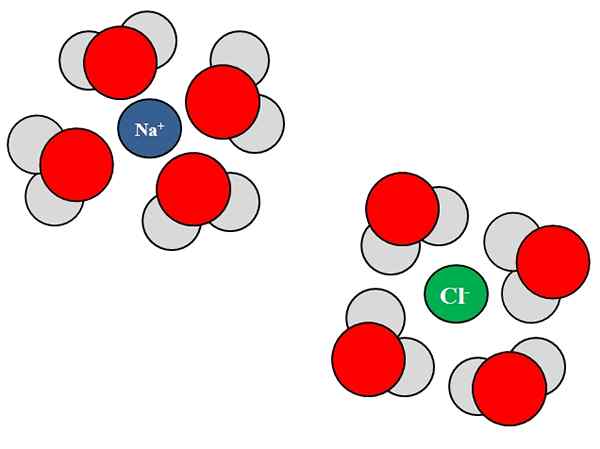 Interações ion-dipolo entre moléculas de água e íons NaCl. Fonte: Gabriel Bolívar.
Interações ion-dipolo entre moléculas de água e íons NaCl. Fonte: Gabriel Bolívar. Iones também podem interagir com átomos ou moléculas neutras, como água. Isso é especialmente verdadeiro quando se trata das moléculas de um solvente, que solvata, ou seja, envolve os íons dentro de seu líquido.
Por exemplo, cloreto de sódio, NaCl, consiste em íons Na+ e cl-. Quando seus cristais são jogados na água, as moléculas de água, h2O ou hoh, hidratar ou envolver os íons de NaCl; Mas a maneira como eles fazem varia dependendo do íon em questão.
Assim, vemos na imagem superior que o íon na+ é hidratado por átomos de oxigênio H h2QUALQUER. Enquanto isso, o íon Cl- é hidratado por átomos de hidrogênio.
Porque? Porque a água é uma substância polar, o que significa que ela tem um dipolo: um poste com uma carga parcial positiva e outra com uma carga parcial negativa.
O átomo de oxigênio, porque é mais eletronegativo, atrai os elétrons em direção a si mesmos, localizando assim os elétrons com mais frequência ao redor desse átomo; algo que não acontece o mesmo com átomos de hidrogênio, menos eletronegativo. Oxigênio, porque é mais negativo, é orientado para NA+; Enquanto hidrogênios, porque são mais positivos, são orientados para o CL-, Uma vez que as acusações opostas são atraídas.
Induzido ion-dipolo
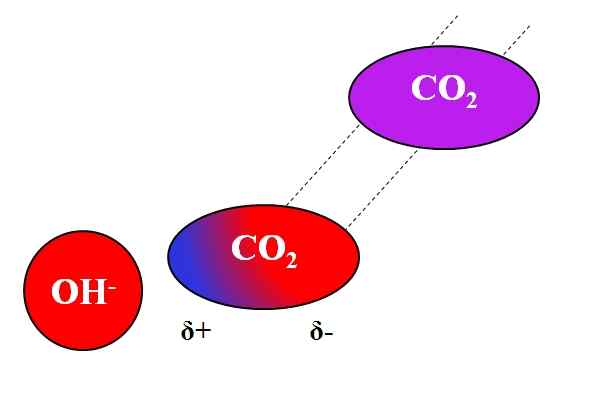 Ação indutiva oh- na molécula de co₂. Fonte: Gabriel Bolívar.
Ação indutiva oh- na molécula de co₂. Fonte: Gabriel Bolívar. Não apenas moléculas polares ou dipolas podem interagir com íons. Para átomos ou moléculas neutras, mesmo que não tenham dipolos, a distribuição de seus elétrons é suscetível aos efeitos indutivos de íons próximos; isto é, os íons causam uma polarização momentânea e breve, o suficiente para uma interação notável.
Pode atendê -lo: liderar acetato: estrutura, propriedades, obtenção, usosSuponha, por exemplo, a interação entre o Íon OH- e o co2. O co2 É um composto neutro, cuja molécula (em roxo) não tem dipolo. No entanto, como oh se aproxima-, A carga negativa desse repele aos elétrons dos átomos de oxigênio do CO2.
Quanto mais perto é oh- e o co2, mais forte será repulsão. Consequentemente, um dipolo induzido pelo OH começa a ser estabelecido- Sobre co2. Um pólo positivo aparece Δ+ porque os elétrons, repelidos, "emigrar" para a outra extremidade da molécula.
Assim, oh- e o co2 Eles permanecem o suficiente juntos para reagir um com o outro. Esta é a razão pela qual co2 É particularmente solúvel em soluções alcalinas.
Van der Waals forças
As forças de van der Waals, em princípio, referem -se apenas àquelas que existem entre átomos neutros ou moléculas, sem cargas iônicas.
Dipolo-dipolo (Keesom)
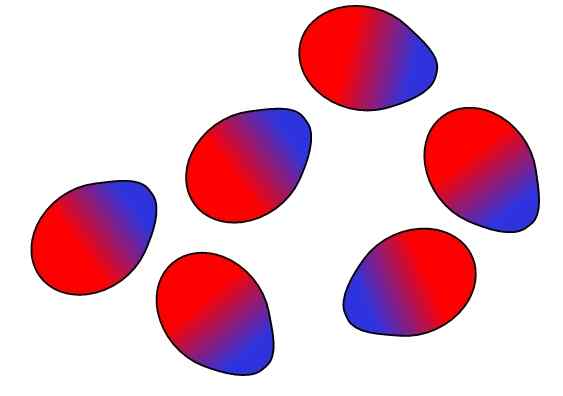 Forças Dipolo-Dipolo. Fonte: Gabriel Bolívar.
Forças Dipolo-Dipolo. Fonte: Gabriel Bolívar. Cargas opostas são atraídas, cargas iguais repelem. O mesmo vale para os dipolos: pólos opostos (Δ+ e Δ-) são atraídos, enquanto pólos iguais repelem. Os pólos positivos ou Δ+ são representados acima com a cor azul, no entanto, que os pólos negativos ou Δ- são representados com a cor vermelha.
Observe como as moléculas superiores são orientadas e ordenadas de tal maneira que os pólos opostos sejam, afastando -se no processo para os pólos iguais. Esta ordem é o que é conhecido como interações ou forças dipolo-dipolo (forças de Keesom) e são as forças intermoleculares mais importantes entre as moléculas polares.
Por exemplo, moléculas H2Ou HCl, HF, CO, entre outros, eles são ordenados em modos semelhantes. Quanto mais polares forem, mais fortes serão suas forças dipolo-dipolo; E, portanto, mais difícil será separar suas moléculas.
O HF é mais polar que o HCl, então o ponto de ebulição do HF é superior (19.5 ºC) para o HCl (-85.05 ºC). É incrível o efeito que as forças intermoleculares têm nas propriedades físicas. A menor variação, e a substância se comportará totalmente diferente do que era esperado.
Pode servir a você: Estado gasoso: características, direito geral, exemplosDipolo-dipolo induzido (Debye)
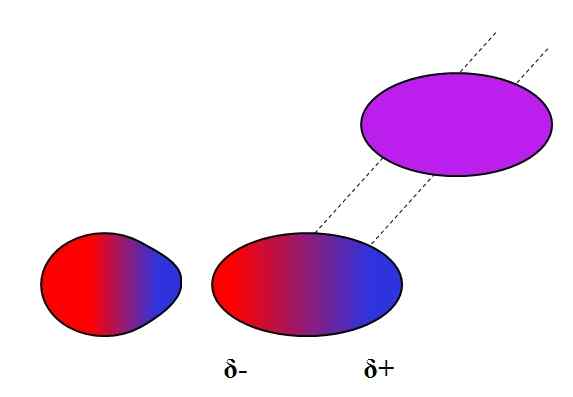 Dipolo-dipolo induzido. Fonte: Gabriel Bolívar.
Dipolo-dipolo induzido. Fonte: Gabriel Bolívar. Dipolos, como íons, também podem flutuar ou afetar a distribuição eletrônica de átomos neutros ou moléculas. Assim, vemos, na imagem superior, que um dipolo polariza de repente uma molécula neutra. Dizem que é uma força dipolo-dipolo induzida, porque o segundo dipolo é momentâneo, não permanente.
Por exemplo, a água é capaz de dissolver uma pequena quantidade de ou2, Mas o suficiente para a fauna marinha respirar. Se h2Ou não poderia induzir um dipolo no O2, Todo o oxigênio dos mares escaparia da superfície, porque não haveria interações entre as duas moléculas.
Dipolo instantâneo induzido por dipolo (Londres)
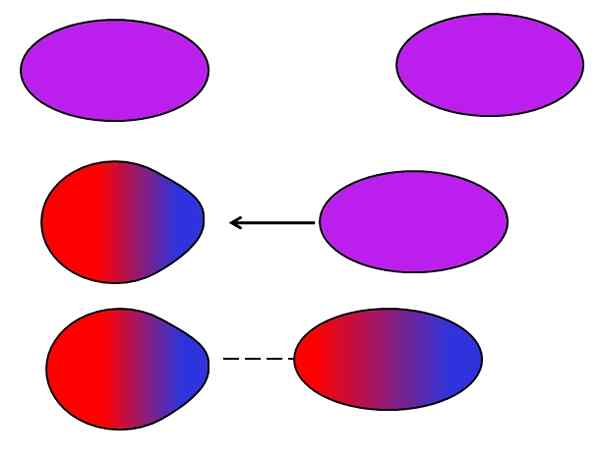 Forças de Londres. Fonte: Gabriel Bolívar.
Forças de Londres. Fonte: Gabriel Bolívar. Átomos ou moléculas neutras não precisam de íons ou dipolos vizinhos para sofrer para si mesmas flutuações na distribuição de suas cargas internas. Os elétrons não estão parados, mas se movem por toda a molécula. Em algum momento, ocorrerá um dipolo instantâneo, que se estiver muito próximo de uma molécula ou átomo neutro, induzirá um dipolo neles (veja acima).
Quanto maiores e assimétricas essas moléculas, maior a probabilidade de os dipolos instantâneos ocorrer. É por isso que os compostos das massas atômicas mais altas têm um instante induzido por forças dipol mais intensas. Este tipo de forças de van der Waals é mais conhecido como forças de Londres.
Por exemplo, gases nobres (ele, NE, AR, etc.) Eles permanecem unidos graças às forças de Londres, assim como os gases aéreos (ou2, N2, Co2, etc.). Além disso, essa força é a mais predominante entre hidrocarbonetos como o metano, CHO4, E propano, Cho3CH2CH3.
Forças hidrofóbicas
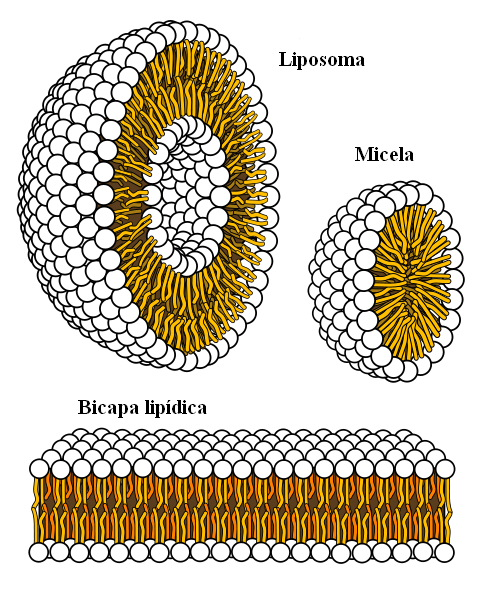 Estruturas supramoleculares originadas de forças hidrofóbicas
Estruturas supramoleculares originadas de forças hidrofóbicas Finalmente, temos forças hidrofóbicas, que são um resultado especial das forças e repulsões de Londres entre substâncias com diferentes polaridades. As gorduras estão pouco relacionadas à água, por isso é insolúvel neste.
As moléculas de gordura procuram agrupar de tal maneira que suas interações com a água sejam o máximo possível, e isso consegue formar estruturas 3D como as mostradas acima.
Assim, moléculas de gordura, como fosfolipídios, se reúnem para formar bicamadas lipídicas, micelas e lipossomas.
Se observado, essas moléculas têm uma cabeça branca que representa uma porção polar, relacionada à água; bem como uma cauda apolar, que repele as moléculas de água. As linhas procuram se colocar dentro dessas estruturas supramoleculares, para que não interajam com a água.

