Precipitação química

- 1109
- 320
- Lonnie MacGyver
 Tanque de sedimentação para tratamento de água
Tanque de sedimentação para tratamento de água O que é precipitação química?
O Precipitação química É um processo de tratamento de águas residuais no qual substâncias químicas são adicionadas para transformar íons poluentes dissolvidos em partículas sólidas. Em outras palavras, consiste em gerar partículas sedimentares em águas residuais pela adição de produtos químicos.
O principal objetivo da chuva química.
Embora a maioria dos poluentes procurados para eliminar sejam metais como cobalto, césio ou mercúrio que formam cátions (íons com carga positiva), ele também é usado para eliminar ânions (íons com carga negativa) como fluoreto, cianeto e fosfato.
Uma vez que os sólidos precipitem, é necessário realizar uma série de etapas para poder separá -lo do resto da água. Essas etapas incluem floculação, sedimentação e separação de líquido sólido.
O equilíbrio de solubilidade e precipitação química
A técnica de precipitação química é baseada no equilíbrio da solubilidade de compostos iônicos e na constante do produto de solubilidade. Na maioria dos casos, os sólidos que precipitam são pequenos hidróxidos solúveis, embora outros tipos de íons também sejam precipitados.
Em todos os casos de precipitação química, o sólido formado é um pouco de composto iônico solúvel que está em equilíbrio com os íons em solução de acordo com a reação geral:
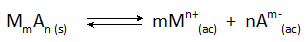
A concentração final do metal, M, que permanece na solução é determinada pela constante de equilíbrio dessa reação, bem como pela concentração do ânion, a, que é adicionado.
Por exemplo, Se for um hidróxido, a concentração final do metal dependerá da concentração de íons hidróxidos na solução e, portanto, do pH.
Processo de precipitação química passo a passo
O processo de precipitação química consiste em quatro etapas básicas:
Etapa 1: Adição do agente precipitante e ajuste de pH.
Este é o estágio inicial em que o agente precipitado que foi selecionado é adicionado (na maioria dos casos, é hidróxido de cálcio). O pH se ajusta para maximizar a precipitação e otimizar a pureza final da água.
Pode atendê -lo: acrilonitrilo: estrutura, propriedades, produção, usosDurante esta etapa, a mistura é normalmente batida ou agitada para garantir uma concentração precipitante uniforme.
Etapa 2: Floculação.
Este estágio é permitir que os pequenos sólidos formados na primeira etapa da precipitação se juntem formando partículas ou "flocos" (daí o nome deles).
Estes sedimentarão mais rapidamente na próxima etapa. Para favorecer a formação dessas partículas sem quebrá -las, a agitação se torna mais lentamente.
Etapa 3: Sedimentação.
Consiste em deixar a mistura de água recém -tratada em um tanque para deixar todas as partículas sólidas irem para o fundo (sedimento).
Etapa 4: Separação de líquido sólido.
Na maioria dos casos, a separação de líquido sólido consiste em uma simples decantação da água que permanece o sedimento. Em outros casos, a separação é alcançada filtrando ou mesmo a água tratada centrifugante, dependendo de como os poluentes são perigosos.
Tipos de precipitação química
Precipitação de hidróxido
Este é o tipo mais comum de precipitação química e consiste em aumentar o pH adicionando um composto alcalino que quase sempre é hidróxido de cálcio (CA (OH)2).
A reação química que ocorre é:

Na reação anterior, M representa qualquer cátion do metal desejado para eliminar. O sólido formado neste caso é muito pouco hidróxido solúvel.
No caso de precipitação de hidróxido, a regra geral é que quanto maior a concentração de OH- (Quanto maior o pH), menor a concentração do metal que permanece na água, depois de tratados. Em outras palavras, para maior pH, maior pureza final da água.
Precipitação com sulfetos
Esse tipo de precipitação química é usada principalmente para a eliminação de metais pesados, como chumbo ou mercúrio, na forma de muito pouco sulfetos solúveis. Para conseguir isso, ele pode ser adicionado à água para tratar sulfetos solúveis e insolúveis.
Os sulfetos mais usados são solúveis que incluem sulfeto de hidrogênio (H2S) e sulfeto de sódio (NA2S). A reação geral da precipitação é:
Pode atendê -lo: liga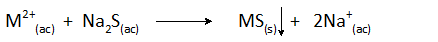
Também pode ser adicionado sulfeto ferroso, o que é insolúvel, mas fornece íons sulfeto suficientes para a solução para precipitar a maioria dos metais pesados.
Precipitação de carbonato
Os carbonatos de muitos metais são menos solúveis até que os hidróxidos e podem precipitar as águas residuais adicionando carbonato de cálcio ou girando hidróxidos borbulhando dióxido de carbono na mistura alcalinizada na mistura alcalinizada.
Precipitação de cianeto
Ao contrário dos casos anteriores, aqui procuramos precipitar cianeto, que é um ânion, em vez de um metal. O cianeto é um contaminante venenoso muito perigoso e pode ser removido das águas residuais adicionando sulfato de zinco ou sulfato ferroso, pois se forma complexa com esses metais que precipitam.
Coprecipitação
A coprecipitação ocorre quando um soluto precipita junto com outro. Nesses casos, o primeiro soluto é capturado no sólido quando um precipitado de outro composto é formado.
É como se o sólido ao formar deixasse o primeiro soluto e o arraste para fora da solução. Esse fenômeno é usado para eliminar alguns poluentes que são difíceis de se precipitar.
Formulários
A precipitação química é usada em indústrias sem fim para atender aos requisitos ambientais da qualidade das águas residuais.
Precipitação de hidróxido É usado nas indústrias de:
- Acabamentos de metal
- Fabricação de compostos inorgânicos
- Fundamentos
- Fabricação de fogos de artifício e explosivos
- Esmalte de porcelana
- Mineração de carvão
- A indústria farmacêutica, entre outros.
Por outro lado, Precipitação com sulfetos É usado na indústria para eliminar contaminantes como mercúrio, chumbo e prata. Isso tem aplicação nas seguintes indústrias:
- Indústria têxtil
- Mineração
- Equipamentos e suprimentos fotográficos
- Fabricação de metais não ferrosos, entre outros
Além dessas indústrias, a precipitação é a técnica mais importante para Purificação de água de resfriamento de reatores nucleares. Nesta indústria, é usado para eliminar cátions radioativos como Plutônio, Américo, Cesio e outros.
Exemplos de precipitação química
Precipitação de estrôncio com carbonato de cálcio
A reação de precipitação neste caso é:
Pode atendê -lo: óxidos de nitrogênio (NOX)
A reação é realizada para um pH ideal de 10,5 e atinge concentrações desse metal até 100 vezes menor que o inicial.
Precipitação de hidróxido de antimônio
Para eliminar o antimônio das águas residuais, o hidróxido de titânio pode ser usado como um reagente precipitado. A reação é:

Isso é realizado em uma faixa de pH que vai de 5 a 8,5 e também reduz a concentração para um valor 100 vezes menor que o inicial.
Precipitação de césio com tetrafenilborato
Este é um caso especial que permite a precipitação do Cessium, um metal alcalino difícil de precipitar. A reação é:

O uso do tetrafenilborarato traz dois grandes benefícios: primeiro, que funciona praticamente para qualquer pH (de pH 1 a 13) e segundo, que a baixa solubilidade do sal formada permite reduzir a concentração final do contaminante por mil fatores de mil.
Precipitação de cobre com sulfeto de sódio
A reação de precipitação neste caso é:
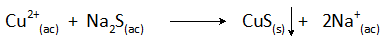
A remoção de cobre de águas residuais por esse método é realizada em valores de pH maiores que 8 e sua concentração é reduzida em mais de 99%.
Coprecipitação de cromo, chumbo e zinco com hidróxido férrico e hidróxido de alumínio
Nesse caso, o hidróxido de sódio é adicionado à água para precipitar ferro e alumínio que está presente na forma de hidróxido férrico (fé (OH)3) e hidróxido de alumínio (Al (OH)3). Quando esses dois hidróxidos precipitam, eles arrastam parte dos íons cromados, chumbo e zinco. O tratamento posterior com sulfeto de hidrogênio remove quase todos esses três metais.
Referências
- Wang, l. K., Vaccari, d. PARA., Li, e., & Shammas, n. K. (2005). Precipitação química. Processos de Tratamento Fisicêmico, 141-197. Doi: 10.1385/1-59259-820-X: 141
- STRIEBIG, b.PARA. (2005). Precipitação química. Na enciclopédia de água (eds. J.H. Lehr e J. Keeley). https: // doi.org/10.1002/047147844X.PC101
- Britannica, t. Editores de Encyclopaedia (2018, 8 de fevereiro). Precipitação química. Enciclopédia Britannica. https: // www.Britannica.com/ciência/precipitação química
- D. Bhattacharyya, a. B. Jumawan Jr. & R. B. Grieves (1979) Separação de metais pesados tóxicos por precitação em sulfeto, Ciência e Tecnologia de Separação, 14: 5, 441-452, doi: 10.1080/01496397908058096
- Marina Maya Marchioretto, Harry Bruning & Wim Rulkens (2005) Precisão de metais pesados em lodo de esgoto, ciência e tecnologia de separação, 40:16, 3393-3405, doi: 10: 10.1080/01496390500423748

