Moléculas apolares
- 4192
- 733
- Ralph Kohler
As Moléculas apolares Eles são aqueles que apresentam em sua estrutura uma distribuição simétrica de seus elétrons. Isso é possível se a diferença de eletronegatividade de seus átomos for pequena, ou se os átomos ou grupos eletronegativos cancelarem seus efeitos na molécula.
Nem sempre a "apolaridade" é absoluta. Por esse motivo, moléculas de polaridade ruins são consideradas apolares; isto é, tem um momento dipolar µ próximo a 0. Aqui você entra no campo relativo: quão baixo deve ser µ para que uma molécula ou composto seja considerado apolar?
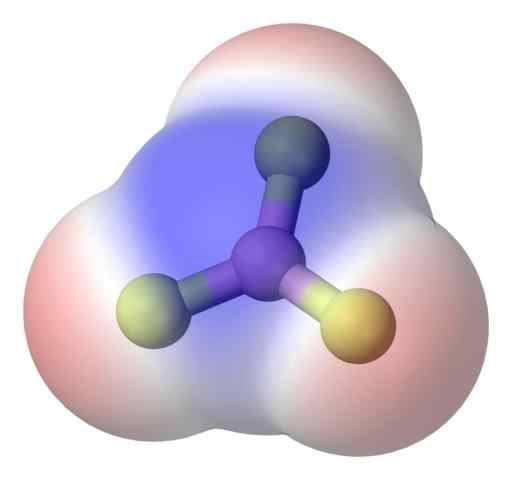
 Molécula Apolar BF3. Fonte: Benjah-BMM27 via Commons Wikimedia.
Molécula Apolar BF3. Fonte: Benjah-BMM27 via Commons Wikimedia. Para resolver melhor o problema, você tem a molécula de Trifluoreto de Boron, BF3 (Imagem superior).
O átomo de flúor é muito mais eletronegativo que o de Boro e, portanto, os links B-F são polares. No entanto, a molécula de BF3 É simétrico (plano trigonal) e implica o cancelamento do vetor dos três momentos B-F.
Assim, moléculas apolares também são geradas, mesmo com a existência de links polares. A polaridade gerada pode ser equilibrada pela existência de outro elo polar, da mesma magnitude que o anterior, mas orientado na direção oposta; Como é o caso no namorado3.
Características de uma molécula apolar
Simetria
Para que os efeitos dos links polares se cancelassem, a molécula deve ter uma estrutura geométrica específica; Por exemplo, linear, o mais fácil de entender à primeira vista.
Este é o caso de dióxido de carbono (CO2), que possui dois links polares (o = c = o). Isso ocorre porque os dois momentos dipolares dos links c = O são cancelados quando um é orientado para um lado, e o segundo para o outro, em um ângulo de 180 °.
Pode atendê -lo: transaminaçãoPortanto, uma das primeiras características a levar em consideração quando a "apolaridade" de uma molécula é avaliada por vôo de pássaros, é observar o quão simétrico é.
Suponha isso em vez de co2 Você tem a molécula cos (o = c = s), chamada de sulfeto de carbonil.
Agora não é mais uma molécula apolar, uma vez que a eletronegatividade de enxofre é menor que o oxigênio; E, portanto, o momento dipolo c é diferente do C = O. Como resultado, o COS é uma molécula polar (o polar é uma farinha de outro saco).
A imagem inferior resume graficamente tudo recentemente descrito:
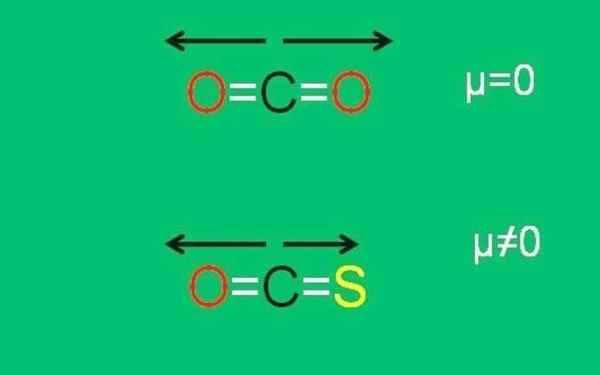 XXX Momentos dipolares das moléculas de CO2 e COS. Fonte: Gabriel Bolívar.
XXX Momentos dipolares das moléculas de CO2 e COS. Fonte: Gabriel Bolívar. Observe que o momento dipolar do link c = s é menor que o link c = o na molécula COS.
Eletro-negatividade
A eletronegatividade na escala Pauling possui valores entre 0,65 (para Frania) e 4.0 (para fluoreto). Em geral, os halogênios têm alta eletronegatividade.
Quando a diferença na eletronegatividade dos elementos que formam uma ligação covalente é menor que 0,4, diz -se que é apolar ou não polar. No entanto, as únicas moléculas verdadeiramente apolares são as formadas por vínculos entre átomos idênticos (como hidrogênio, H-H).
Forças intermoleculares
Para que uma substância se dissolva na água, ela deve interagir eletrostaticamente com as moléculas; interações que não podem executar moléculas apolares.
Nas moléculas apolares, suas cargas elétricas não são confinadas em uma extremidade da molécula, mas distribuídas simetricamente (ou homogeneamente). Portanto, ele é incapaz de interagir através das forças dipolo-dipolo.
Pode atendê -lo: volume atômicoEm vez disso, as moléculas apolares interagem entre si através das forças de dispersão de Londres; São dipolos instantâneos que polarizam a nuvem eletrônica de átomos de moléculas vizinhas. Aqui a massa molecular é um fator predominante nas propriedades físicas dessas moléculas.
Como identificar moléculas apolares?
-Talvez um dos melhores métodos para identificar uma molécula apolar seja sua solubilidade em diferentes solventes polares, sendo geralmente pouco solúvel neles.
-Em geral, as moléculas apolares são de natureza gasosa. Eles também podem ser líquidos imiscíveis com água.
-Os sólidos apolares são caracterizados por serem macios.
-As forças de dispersão que as mantêm juntas são geralmente fracas. Por causa disso, seus pontos de fusão ou ebulição tendem a ser inferiores aos dos compostos polares.
-As moléculas apolares, especialmente na forma líquida, são maus condutores de eletricidade, pois não têm carga elétrica líquida.
Exemplos de moléculas apolares
gases nobres
Embora não sejam moléculas, os gases nobres são considerados apolares. Se for assumido que dois de seus átomos interagem por breves períodos de tempo, essa interação poderá ser considerada (metade) como uma molécula; molécula que seria a natureza apolar.
Moléculas diatômicas
Moléculas diatômicas, como H2, o Br2, o i2, O cl2, o o2, e f2, Eles são apolares. Estes são geralmente2, A-a.
Hidrocarbonetos
E se fosse um grupo de átomos? Seria antes de outros compostos apolares; Por exemplo, etano, Cho3-CH3, cujo esqueleto de carbono é linear, C-C.
Metano, cap4, e o etano, c2H6, São moléculas apolares. O carbono tem uma eletronegatividade de 2,55; Enquanto o hidrogênio eletronegatividade é 2.2. Portanto, existe um vetor dipolo de baixa intensidade, orientado de hidrogênio para carbono.
Pode servir a você: Método Mohr: Fundamentos, Reações, Procedimento, UsosMas, devido à simetria geométrica de moléculas de metano e etano, a soma dos vetores dipolares ou momentos dipolares em suas moléculas é nula, portanto não há carga líquida nas moléculas.
Em geral, o mesmo acontece com todos os hidrocarbonetos e, mesmo quando há insaturação neles (ligações duplas e triplas), elas são consideradas apolares ou compostos de baixa polaridade. Além disso, hidrocarbonetos cíclicos são moléculas apolares, como ciclohexana ou ciclobutano.
Outros
Moléculas de dióxido de carbono (CO2) e dissulfeto de carbono (CS2) São moléculas apolares, ambas com uma geometria linear.
No dissulfeto de carbono, a eletronegatividade de carbono é de 2,55, enquanto a eletronegatividade de enxofre é de 2,58; Portanto, ambos os elementos têm, praticamente, a mesma eletronegatividade. Não há geração de um vetor dipolo e, portanto, a carga líquida é zero.
Além disso, as seguintes moléculas de CCL estão disponíveis4 e Albr3, Ambos Apolar:
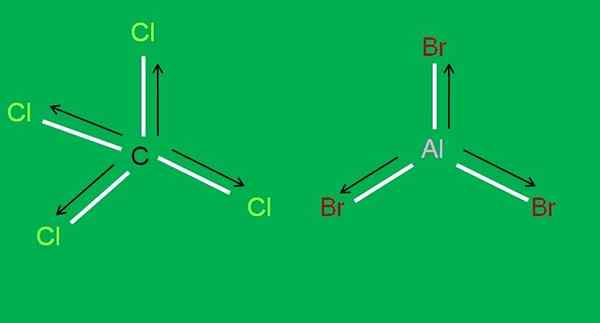 Moléculas CCL4 e ALBR3. Fonte: Gabriel Bolívar.
Moléculas CCL4 e ALBR3. Fonte: Gabriel Bolívar. Em tribrometo de alumínio, albb3 O mesmo acontece com o BF3, No início do artigo. Enquanto isso, para tetracloreto de carbono, CCL4, A geometria é tetraédrica e simétrica, uma vez que todos os links C-Cl são iguais.
Da mesma forma, moléculas com a fórmula geral CX4 (Cf4, CI4 e CBr4), eles também são apolares.
E, finalmente, uma molécula apolar pode até ter geometria octaédrica, como é o caso de hexafluoreto de enxofre, SF6. De fato, você pode ter qualquer geometria ou estrutura, desde que seja simétrica e sua distribuição eletrônica seja homogênea.
Referências
- Molécula não polar. Recuperado de: química.Tutorvista.com
- Exemplo de moléculas polares e não polares. Recuperado de: pensamento.com
- « Equilíbrio de matéria o que é, equação geral, tipos
- Daniel Servitje Montull Biografia, Liderança e Contribuições »

