Características do modelo atômico de Thomson, postulados, partículas subatômicas
- 1543
- 18
- Conrad Schmidt
Ele Modelo Atômico de Thomson Foi criado pelo Físico Inglês Celebrated J. J. Thomson, que descobriu o elétron. Devido a essa descoberta e seus trabalhos sobre condução elétrica em gases, foi concedida em 1906 com o Prêmio Nobel de Física.
De seu trabalho com os raios do cátodo, foi revelado que o átomo não era uma entidade indivisível, como Dalton havia postado no modelo anterior, mas que continha uma estrutura interna bem definida.

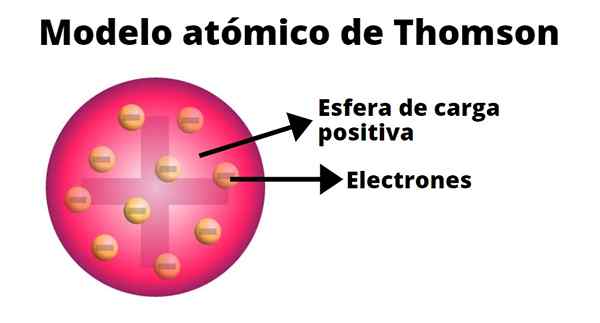
Thomson desenvolveu um modelo Atom baseado nos resultados de seus experimentos com raios de cátodo. Nele, ele afirmou que o átomo, eletricamente neutro, era formado de cargas positivas e negativas de igual magnitude.
[TOC]
Qual era o nome do modelo atômico de Thomson e por quê?
Segundo Thomson, a carga positiva foi distribuída por todo o átomo e as cargas negativas foram incorporadas nela como se fossem as passas de um pudim. A partir desta comparação, surgiu o termo "pudim de passas", pois o modelo era informalmente conhecido.
 Joseph John Thomson
Joseph John Thomson Enquanto a ideia de Thomson é atualmente bastante primitiva, por seu tempo ele representou uma nova contribuição. Durante a breve validade do modelo (de 1904 a 1910), ele teve o apoio de muitos cientistas, embora muitos outros considerassem isso heresia.
Finalmente, em 1910, surgiram novas evidências sobre a estrutura atômica e o modelo de Thomson rapidamente permaneceu de lado. Isso aconteceu assim que Rutherford publicou os resultados de seus experimentos de dispersão, que mostraram a existência do núcleo atômico.
No entanto, o modelo de Thomson foi o primeiro a postular a existência de partículas subatômicas e seus resultados foram frutos de uma experimentação fina e rigorosa. Dessa forma, ele estabeleceu o precedente para todas as descobertas que se seguiram.
Características e postulados do modelo Thomson
Thomson chegou ao seu modelo atômico com base em várias observações. O primeiro foi que os Rains X recentemente descobertos por Roentgen foram capazes de ionizar as moléculas de ar. Até então, a única maneira de ionizar era separar quimicamente os íons em uma solução.
Mas o físico inglês ioniza com sucesso até gases monoatômicos como o hélio, através de raios X. Isso o levou a acreditar que a carga dentro do átomo poderia ser separada e que, portanto, não era indivisível.Ele também observou que os raios catódicos poderiam ser desviados por campos elétricos e magnéticos.
 J.J. Thomson, descobridor do elétron. Fonte: Lafer.
J.J. Thomson, descobridor do elétron. Fonte: Lafer. Então Thomson criou um modelo que explicou corretamente o fato de que o átomo é eletricamente neutro e que os raios do cátodo são compostos de partículas com carga negativa.
Excepção de evidências experimentais, Thomson caracterizou o átomo da seguinte forma:
-O átomo é uma esfera sólida eletricamente neutra, com um raio aproximado de 10-10 m.
-A carga positiva é distribuída de forma mais ou menos uniformemente pela esfera.
-O átomo contém "corpúsculos" carregados negativamente, o que garante sua neutralidade.
-Esses corpúsculos são os mesmos para toda a matéria.
-Quando o átomo está em equilíbrio, há n corpúsculos organizados regularmente em anéis dentro da esfera de carga positiva.
-A massa do átomo é distribuída uniformemente.
Raios de cátodo
 O feixe de elétrons é direcionado do cátodo para o ânodo.
O feixe de elétrons é direcionado do cátodo para o ânodo. Thomson realizou seus experimentos usando raios de cátodo, descobertos em 1859. Os raios catódicos são partículas carregadas negativamente. Para produzi -los, são usados tubos de cristal a vácuo, nos quais dois eletrodos são colocados, chamados cátodo e ânodo.
Pode atendê -lo: magnetismo: propriedades magnéticas de materiais, usosEm seguida, é passada uma corrente elétrica que aquece o cátodo, que emite radiação invisível que é direcionada diretamente ao eletrodo oposto.
Para detectar radiação, o que não é nada além dos raios catódicos, a parede do tubo é coberta com um material fluorescente. Quando a radiação chega lá, a parede do tubo emite uma intensa luminosidade.
Se um objeto sólido estiver interposto no caminho dos raios de cátodo, ele lança uma sombra na parede do tubo. Isso indica que os raios viajam em linha reta, e também que eles podem facilmente bloqueá -los.
A natureza dos raios do cátodo foi amplamente discutida, uma vez que sua natureza era um desconhecido. Alguns pensaram que eram ondas eletromagnéticas, enquanto outros argumentaram que eram partículas.
Partículas subatômicas de Modelo Atômico de Thomson
O modelo atômico de Thomson é, como dissemos, o primeiro a postular a existência de partículas subatômicas. Os corpúsculos de Thomson não são nada além de elétrons, as partículas fundamentais do átomo carregado negativamente.
Atualmente sabemos que as outras duas partículas fundamentais são o próton, carregado positivamente, e o nêutron sem carga.
Mas estes não foram descobertos na época em que Thomson elaborou seu modelo. A carga positiva no átomo foi distribuída nela, não considerou nenhuma partícula por carga e, no momento, não havia evidências de sua existência.
Por esse motivo, seu modelo tinha uma existência fugaz, já que, no decorrer de alguns anos, os experimentos de dispersão de Rutherford abriram o caminho para a descoberta do próton. E quanto ao nêutron, o próprio Rutherford propôs sua existência alguns anos antes de ser finalmente descoberto.
O tubo de Crookes
Sir William Crookes (1832-1919) projetou o tubo que leva seu nome por volta de 1870, com a intenção de estudar cuidadosamente a natureza dos raios do cátodo. Ele acrescentou campos elétricos e campos magnéticos e observou que os raios foram desviados por estes.
 Esquema de tubo de raio catódico. Fonte: Knight, r.
Esquema de tubo de raio catódico. Fonte: Knight, r. Dessa forma, Crookes e outros pesquisadores, incluindo Thomson, descobriram que:
- Uma corrente elétrica foi gerada dentro do tubo do raio catódico
- Os raios foram desviados pela presença de campos magnéticos, da mesma maneira que as partículas carregadas negativamente foram.
- Qualquer metal usado para fabricar o cátodo era igualmente bom para produzir raios de cátodo, e seu comportamento era independente do material.
Essas observações alimentaram a discussão em torno da origem dos raios do cátodo. Aqueles que argumentaram que eram ondas eram baseados no fato de que os raios do cátodo poderiam viajar em uma linha reta. Além disso, essa hipótese explicou muito bem a sombra que um objeto sólido interposto jogou na parede do tubo e, sob certas circunstâncias, sabia -se que as ondas poderiam causar fluorescência.
Mas, em vez disso, não se entendeu como era possível que os campos magnéticos tenham desviado os raios do cátodo. Isso só teve explicação se esses raios fossem considerados partículas, uma hipótese que Thomson compartilhou.
Partículas carregadas em campos elétricos e magnéticos uniformes
Uma partícula carregada com carga Q, experimenta uma força de fé no meio de um campo elétrico uniforme e, de magnitude:
Pode servir a você: Teoria Onduladora da Luz: Explicação, Aplicações, ExemplosFé = QE
Quando uma partícula carregada perpendicularmente atravessa um campo elétrico uniforme, como o que ocorre entre duas placas com cargas opostas, ela experimenta um desvio e, portanto, uma aceleração:
qe = ma
a = qe/m
Por outro lado, se a partícula carregada se mover com velocidade de magnitude V, no meio de um campo magnético uniforme de magnitude B, a força magnética FM que experimenta tem a seguinte intensidade:
Fm = qvb
Enquanto os vetores de velocidade e campo magnético forem perpendiculares. Quando uma partícula carregada afeta perpendicularmente em um campo magnético homogêneo, também experimenta um desvio e seu movimento é uniforme circular.
Aceleração centrípeta parac Nesse caso, é:
Qvb = mac
Por sua vez, a aceleração centrípeta está relacionada à velocidade da partícula V e ao raio r da trajetória circular:
parac = v2/R
Portanto:
Qvb = mv2/R
O raio da trajetória circular pode ser calculado da seguinte forma:
R = mv/qb
Posterior.
Experiência de Thomson
Thomson passou um feixe de raios de cátodo, um feixe de elétrons, embora ainda não soubesse, através de campos elétricos uniformes. Esses campos são criados entre duas placas condutoras carregadas e separadas a uma pequena distância.
Os raios catódicos também passaram por um campo magnético uniforme, observando o efeito que isso teve no feixe. Tanto em um campo quanto outro, houve uma deflexão nos raios, o que levou Thomson a pensar, com razão, que o feixe era composto por partículas carregadas.
Para verificar, Thomson realizou várias estratégias com os raios do cátodo:
- Variar os campos elétricos e magnéticos até que as forças fossem canceladas. Dessa maneira, os raios do cátodo passaram sem experimentar a deflexão. Combinando forças elétricas e magnéticas, Thomson conseguiu determinar a velocidade das partículas de feixe.
- Anulou a intensidade do campo elétrico, dessa maneira as partículas seguiram uma trajetória circular no meio do campo magnético.
- Combinou os resultados das etapas 1 e 2 para determinar a proporção de carga-mãe dos "corpúsculos".
A proporção de massa de carga eletrônica
Thomson determinou que a proporção de mandy de carga das partículas que constituíam o feixe dos raios do cátodo tem o seguinte valor:
Q/M = 1.758820 x 10 11 C.kg-1.
Onde q representa a carga do "corpuscle", que é na verdade o elétron e m É a massa do mesmo. Thomson seguiu o procedimento descrito na seção anterior, que recriamos aqui passo a passo, com as equações que ele usou.
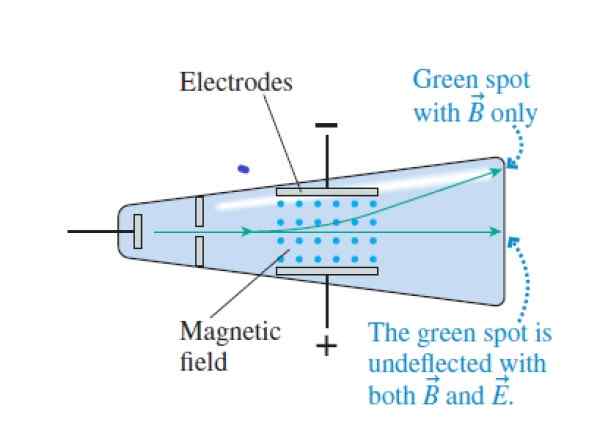 Quando os raios do cátodo cruzam a cruz e os campos magnéticos cruzados, eles passam sem deflexão. Quando o campo elétrico é cancelado, eles afetam a parte superior do tubo (o campo magnético é indicado com os pontos azuis entre os eletrodos). Fonte: Knight, r.
Quando os raios do cátodo cruzam a cruz e os campos magnéticos cruzados, eles passam sem deflexão. Quando o campo elétrico é cancelado, eles afetam a parte superior do tubo (o campo magnético é indicado com os pontos azuis entre os eletrodos). Fonte: Knight, r. Passo 1
Combine a força elétrica e a força magnética, passando o feixe através dos campos elétricos e magnéticos perpendiculares:
Qvb = qe
Passo 2
Determine a velocidade adquirida pelas partículas do feixe quando elas passam diretamente sem deflexão:
V = e/b
etapa 3
Cancele o campo elétrico, deixando apenas o campo magnético (agora há deflexão):
R = mv/qb
Com v = e/b resultados:
R = eu/qb2
O raio da órbita pode ser medido, portanto:
Q/M = V/RB
O bem:
Q/M = E/RB2
Seguintes passos
A próxima coisa que Thomson fez foi medir o quociente Q/M usando cátodos feitos de diferentes materiais. Como afirmado acima, todos os metais emitiam raios de cátodo com características idênticas.
Pode atendê -lo: reatância indutivaEntão Thomson comparou seus valores com os da razão Q/M do íon hidrogênio, obtido por eletrólise e cujo valor é aproximadamente 1 x 108 C/kg. O quociente de carga de elétrons é aproximadamente 1750 vezes maior que o íon hidrogênio.
Portanto, os raios do cátodo tinham carga muito maior, ou talvez uma massa muito menor que o íon hidrogênio. Ion de hidrogênio é simplesmente um próton, cuja existência foi conhecida após os experimentos de dispersão de Rutherford.
Hoje sabe -se que o próton é quase 1800 vezes mais massivo que o elétron e com carga de igual magnitude e sinal ao contrário do elétron.
Outro detalhe importante é que, com as experiências de Thomson, a carga elétrica do elétron não foi determinada, nem o valor de sua massa separadamente. Esses valores foram determinados através das experiências de Millikan, que começaram em 1906.
Thomson e Dalton modelam diferenças
A diferença fundamental desses dois modelos é que Dalton achou que o átomo é uma esfera. Ao contrário de Thomson, ele não propôs a existência de cargas positivas ou negativas. Para Dalton, um átomo era assim:
 Dalton Atom
Dalton Atom Como já vimos antes, Thomson pensou que o átomo era divisível e cuja estrutura é formada por uma esfera positiva e elétrons ao redor.
Falhas e limitações do modelo
Na época, o modelo atômico de Thomson conseguiu explicar muito bem o comportamento químico das substâncias. Ele também explicou corretamente os fenômenos que ocorreram no tubo do raio catódico.
Mas, de fato, Thomson nem chamou suas partículas de "elétrons", embora o termo já tivesse sido cunhado anteriormente por George Johnstone Stoney. Thomson simplesmente os chamou de "corpúsculos".
Embora Thomson tenha feito uso de todo o conhecimento que ele teve no momento, existem várias limitações importantes em seu modelo, que eram evidentes em breve:
-A carga positiva não é distribuída por todo o átomo. Os experimentos de dispersão de Rutherford mostraram que a carga positiva do átomo é necessariamente confinada a uma pequena região, que mais tarde ficou conhecida como núcleo atômico.
-Os elétrons têm uma distribuição específica dentro de cada átomo. Os elétrons não são distribuídos uniformemente, como as passas do famoso Buddine, mas têm uma disposição em orbitais que os modelos subsequentes mostraram.
É precisamente a disposição de elétrons dentro do átomo que permite organizar os elementos para suas características e propriedades na tabela periódica. Essa foi uma limitação importante do modelo Thomson, que não poderia explicar como era possível ordenar os elementos dessa maneira.
-O núcleo atômico é aquele que contém a maior parte da massa. O modelo de Thomson postulou que a massa do átomo foi distribuída uniformemente. Mas hoje sabemos que a massa do átomo está praticamente concentrada nos prótons e nêutrons do núcleo.
Também é importante destacar que esse modelo de átomo não permitiu inferir o tipo de movimento que os elétrons tinham dentro do átomo.
Artigos de interesse
Modelo Atômico de Schrödinger.
Modelo Atômico de Broglie.
Modelo Atômico de Chadwick.
Modelo Atômico de Heisenberg.
Modelo atômico de perrina.
Modelo atômico de Dalton.
Modelo Atômico Dirac Jordan.
Modelo Atômico do Demócrito.
Modelo Atômico de Leucipo.
Modelo atômico Bohr.
Modelo Atômico Sommerfeld.
Modelo atômico atual.
Referências
- Andriessen, m. 2001. Curso HSC. Física 2. Jacaranda HSC Science.
- Arfken, g. 1984. Física da Universidade. Academic Press.
- Cavaleiro, r. 2017. Física para cientistas e engenharia: uma abordagem de estratégia. Pearson.
- Rex, a. 2011. Fundamentos da Física. Pearson.
- Wikipedia. Modelo Atômico de Thomson. Recuperado de: é.Wikipedia.org.
- « Fórmula Geral Equações Quadráticas, Exemplos, Exercícios
- Modelo Aômico de características e postulações de Dirac Jordan »

