Íone de hidronio
- 4651
- 518
- Alfred Kub
Qual é o íon hidrônio?
Ele Íone de hidronio É um tipo de carga positiva que resulta da protonação de uma molécula de água e cuja fórmula química é h3QUALQUER+. Consiste nos oxonianos mais simples: íons onde o oxigênio carrega uma carga formal positiva e tem três ligações covalentes.
O h3QUALQUER+ É um dos cátions mais simples, mas curiosos que existem. Em água em condições normais, tem uma concentração de 1,10-7 M, Produto do equilíbrio da auto -Ação. No entanto, sua concentração aumenta exponencialmente quando forte3QUALQUER+ Eles se dissolvem na água, acidificando -a.
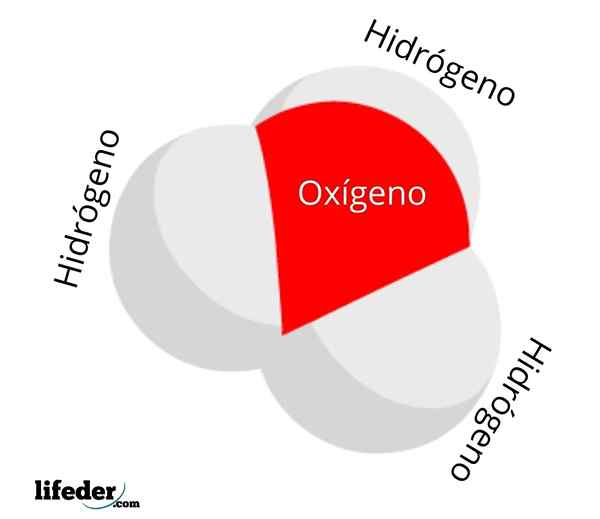
 Molécula de íons de hidrônio
Molécula de íons de hidrônio A concentração ou atividade de H3QUALQUER+ Na água, serve para medir a acidez das soluções aquosas: pH. Quanto mais íons h3QUALQUER+ Feno, menos positivo será pH e mais ácido será a solução em questão. Essa acidez, por outro lado, está no íon hidrogênio, h+, que é frequentemente confundido com ion h3QUALQUER+.
 Fórmula de íons ou hidronio
Fórmula de íons ou hidronio O h+ e sua incrível capacidade de transferir entre as pontes de hidrogênio das moléculas de água permite o H3QUALQUER+ associado em formações de cátions mais complexas; como o cátion de Eigen, H9QUALQUER4+, e o cátion de Zundel, H5QUALQUER2+, e muitos outros.
Estrutura de íons de hidrônio
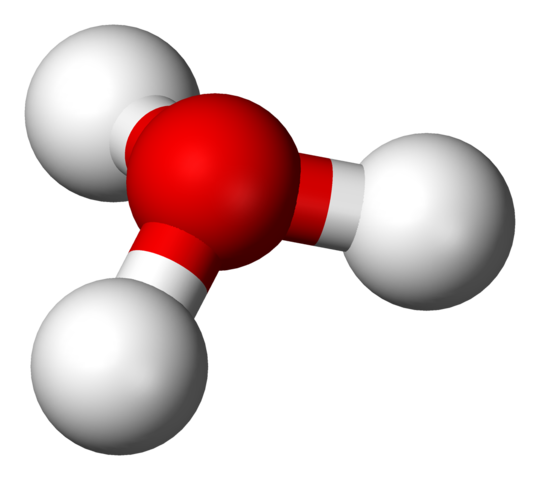 Estrutura H3O+ com um modelo de esferas e barras
Estrutura H3O+ com um modelo de esferas e barras Na primeira imagem, você pode ver a fórmula estrutural do íon hidrium. Agora vemos sua representação com um modelo de esferas e bares. Nos dois destaques, a geometria da pirâmide trigonal, cujos ângulos de ligação (O-H) são 113º; Um pouco desviado de 119º para o tetraedro.
Embora o oxigênio tenha uma carga parcial positiva, isso não significa que a região negativa esteja em torno dos átomos de hidrogênio. O oposto. Oxigênio em h3QUALQUER+ É um produto ainda mais eletronegativo de sua deficiência eletrônica; Portanto, toda a densidade negativa visualizada em um mapa de potencial eletrostático:
Pode servir a você: sulfato de potássio (K2SO4): estrutura, propriedades, usos, síntese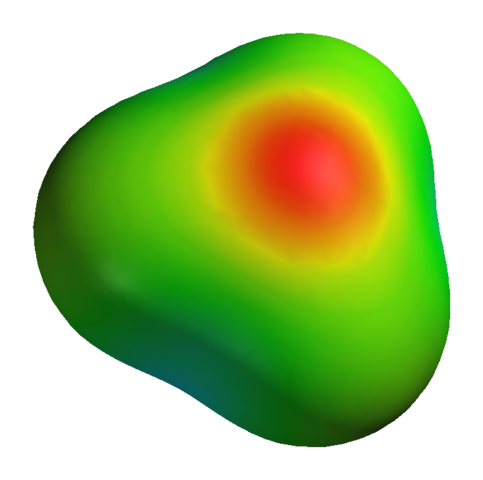 Mapa potencial eletrostático para H3O+
Mapa potencial eletrostático para H3O+ Sem mencionar que o oxigênio tem alguns elétrons livres, o que reforça ainda mais densidade negativa.
Uma conseqüência de tudo o que é acima é que H hidrogênios3QUALQUER+ Eles perdem a densidade eletrônica, porque o oxigênio a atrai em sua direção. Portanto, h3QUALQUER+ Você pode estabelecer fontes de hidrogênio muito fortes com uma molécula de água vizinha: H2QUALQUER+-H-OH2.
Essa interação é a chave por trás da incrível mobilidade iônica de H+ e por que h3QUALQUER+ É capaz de se associar a muitas moléculas de água ao mesmo tempo.
Acidez
O hidronio é um ácido muito forte. De fato, é o ácido mais forte que pode existir em solução aquosa. Porque? Porque qualquer outro ácido mais forte que ele protone uma molécula de água para originar H3QUALQUER+:
Ha + h2O → a- + H3QUALQUER+
O h3QUALQUER+ É capaz de permanecer estável sempre que não há outras bases no ambiente mais fortes que a água. Qualquer ácido cumpriu isso será classificado como um ácido forte. Enquanto isso, se o ácido é mais fraco que H3QUALQUER+, Então, parte do HA não será completamente dissociada e falaremos sobre um ácido fraco:
Ha + h2Ou ⇌ a- + H3QUALQUER+
Portanto, desde H3QUALQUER+ É o ácido mais forte que existe na água, a acidez disso dependerá da concentração de H3QUALQUER+. Esta é a base para definir, em termos simples, a acidez de uma solução aquosa expressa como pH:
ph = -log [h3QUALQUER+]
H+ vs. H3QUALQUER+
Ion de hidrogênio e hidrônio não são os mesmos. O h+ É muito mais ácido do que h3QUALQUER+, Bem, consiste em um próton nada mais, que procurará uma molécula para ganhar elétrons por todos os meios. Quando h+ Obtenha uma molécula de água formas h3QUALQUER+:
Pode atendê -lo: óxido cúprico (CuO)H+ + H2O → h3QUALQUER+
É por isso que H3QUALQUER+ pode ser representado como H+(AC), indicando que é um H+ Em meio aquoso.
A força de um ácido é medida em sua capacidade de doar, de acordo com a definição de Brönsted-Lowry, íons H+. Quanto é mais forte, mais ele doará+, Sem h3QUALQUER+. Os ácidos mais fortes já sintetizados (supercídeos) são aqueles onde h+ Ele está "nu"; isto é, sem nenhum impedimento para pular em direção à molécula que vai protonar.
A prática de representar H3QUALQUER+ cinzas+(AC) É tão comum que há muitas vezes falando sobre ambos como se fossem iguais, sem que isso afete negativamente a interpretação da química das soluções.
Solvatação
O h3QUALQUER+ Pode formar pontes de hidrogênio muito fortes com uma molécula de água vizinha. Ao fazer isso, temos o cátion de Zundel, h5QUALQUER2+:
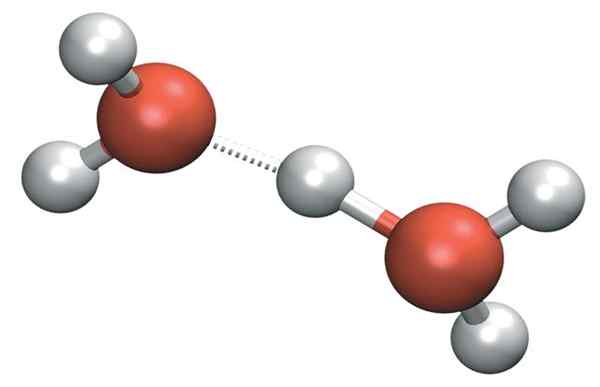 Zundel cátion
Zundel cátion Mas a carga positiva não permanece apenas em um único lado do cátion: isso pode ser transferido para a outra molécula de água como o íon h+:
H2Oh-+Oh2 → h2QUALQUER+-H- oh2
Portanto, a carga positiva é distribuída entre os dois átomos de oxigênio para as duas moléculas de água.
No caso do cátion próprio, H9QUALQUER4+, um H3QUALQUER+ formar pontes de hidrogênio com três moléculas de água, distribuindo entre elas a carga positiva graças a um "salto" h+. Esses saltos são tão rápidos que explicam a grande mobilidade iônica de H+ Na água, usando H3QUALQUER+ como veículo e moléculas de água como uma rodovia.
O h5QUALQUER2+ e h9QUALQUER4+ Eles não são as únicas associações catiônicas que H3QUALQUER+ pode se originar na água. Alguns cálculos de dinâmica molecular demonstram a existência de um cluster H3QUALQUER+(H2QUALQUER)vinte: 20 h moléculas2Ou interagindo com um cátion3QUALQUER+ e distribuir entre eles a carga positiva.
Pode atendê -lo: neodímio: estrutura, propriedades, usosPortanto, h3QUALQUER+ e h+ Eles constroem uma relação curiosa com moléculas de água, além da acidez.
Você sai
Assim como as salas de oxi orgânicas existem, não é exceção com oxi derivado da protonação da água. Sua fórmula geral é [h3QUALQUER+] [X-], Onde x- É qualquer ânion que vem da dissolução de um ácido muito forte.
Esses sais às vezes recebem o nome de 'ácidos monohidratos', já que a fórmula [h3QUALQUER+] [X-] ou h3QUALQUER+· X- Também pode ser escrito como HX · H2QUALQUER. Assim, pode haver ácidos di -hidratos, hx · 2h2Ou, trihidratos, hx · 3h2Ou, etc.
Por exemplo, o HCl pode cristalizar como hcl · h2OH3QUALQUER+· Cl-. Também temos outros sais de hidrônio, como H3QUALQUER+· Clo4- ou hclo4· H2Ou, e hbr · 4h2OH3QUALQUER+· Br-· 3h2QUALQUER.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química InorgánI Ca. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Hidrônio. Recuperado de: em.Wikipedia.org
- Avneet Kahlon e Stephen Lower. (15 de agosto de 2020). O íon hidrônio. Química Librettexts. Recuperado de: química.Librettexts.org
- Helmestine, Anne Marie, Ph.D. (25 de agosto de 2020). Definição de íons de hidrônio. Recuperado de: pensamento.com
- Os editores da Enyclopaedia Britannica. (2020). Íon hidrogênio. Recuperado de: Britannica.com

