Inércia química

- 720
- 62
- Pete Wuckert
O que é inércia química?
A inércia química é a propriedade que tem uma substância ou material para suportar a degradação causada por agentes externos. Nesse sentido. Não há quebras de link ou formação de novos.
Agora, a inércia química é relativa. Algumas substâncias ou materiais são mais inertes do que outros, o que é devido à natureza e força de suas interações. Como poderia, em princípio, contrastar os fenômenos da mudança, indispensável para a matéria evoluir em vários produtos.
 Uma espiada em ouro. O ouro é corrosão mais resistente metal
Uma espiada em ouro. O ouro é corrosão mais resistente metal É por isso que, por mais inerte que seja uma substância ou material, sempre haverá uma condição sob a qual se torna reativa. Por exemplo, o ouro é o mais nobre dos metais e é considerado inerte. No entanto, é atacado e dissolvido pela Royal Water, uma solução para a qual é muito reativa.
Talvez, e até o momento, o único elemento químico que demonstrou uma inércia química absoluta é o neon. Nenhum composto é conhecido, nem mesmo em condições de ultrappressão, como as dos núcleos dos planetas ou luas.
Características de inércia química
Falta de oxidação
Para que um material ou substância seja inerte, em princípio, não deve reagir com o ar circundante. Isso significa que ele não tende a formar vínculos com moléculas de oxigênio ou nitrogênio que cercam sua superfície. Em outras palavras: não oxide a exposição ao ar.
Alimentos e todas as substâncias orgânicas em questão tendem a oxidar. Dizem que eles não são inertes.
A falta de oxidação na inércia química deve ser mantida em temperaturas superiores a 100 ºC. Quanto maior a temperatura, as substâncias ou materiais começarão a oxidar mais rapidamente, reagindo com o oxigênio ou nitrogênio do ar para formar óxidos ou nituros, respectivamente.
Resistência a ácido ou álcalis
Outro recurso presente em inércia química é a resistência a ácidos ou bases. Isso significa que uma substância ou material inerte deve resistir ao ataque de ácidos, sem tendência de se degradar pela aceitação de íons h+ ou eletrofilos muito fortes; ou o ataque das bases, sem degradar por causa dos íons OH-.
Pode atendê -lo: ácido perbrômico (hbro4): propriedades, riscos e usosNovamente, isso é relativo, pois existem diferentes tipos de ácidos e bases. Algumas substâncias inertes podem ser muito resistentes a, digamos, ácido sulfúrico, mas são degradadas em vez da queda mais baixa do ácido fluorforide. É o caso de garrafas de vidro quando reagem com HF.
Estabilidade eletrônica
As características acima têm a ver com a estabilidade termodinâmica derivada da natureza das interações intermoleculares, além de outros fatores. Por outro lado, a inércia química também é vislumbrada nas características eletrônicas dos mesmos átomos.
Quanto mais estável a configuração eletrônica de um átomo, menor sua tendência a ganhar ou perder elétrons. Portanto, exibirá maior inércia química. Este é o caso de gases nobres, que serão vistos na próxima seção.
Bioinatividade
Na medicina, uma substância ou material é inerte se não tiver bioatividade. Isto é, pode ser localizado dentro de um organismo sem ser assimilado durante seu metabolismo. Esse recurso é muito desejável nas próteses ósseas, ou na reconstrução de tecidos.
Resistência à radiação
Finalmente, substâncias ou materiais inertes também devem ser resistentes à radiação, ser ultravioleta ou nuclear.
Exemplos de inércia química
Vidro
 O vidro é um material relativamente inerte
O vidro é um material relativamente inerte Entre os exemplos de materiais que exibem inércia química, temos o vidro. Se não fossem inertes, não serviriam para a elaboração de recipientes ou recipientes, pois reagiriam com seu conteúdo. Dependendo de sua composição, como os borossilicatos, eles podem se tornar muito resistentes à corrosão e temperatura.
No entanto, como mencionado no início, o vidro não é imune a todas as substâncias: reage com a IC, até diluída, alcalis quentes, como NaOH e H3Po4 Muito concentrado e quente.
Pode atendê -lo: pirólisePlásticos
 Se a panela de Teflon não fosse inerte, ela estragaria todos os alimentos que cozinhamos nela. Fonte: Mdevicente, CC0, via Wikimedia Commons
Se a panela de Teflon não fosse inerte, ela estragaria todos os alimentos que cozinhamos nela. Fonte: Mdevicente, CC0, via Wikimedia Commons Os plásticos também cumprem funções semelhantes às do vidro, mas há muito mais versáteis (eles não quebram tão facilmente). Alguns plásticos, como Teflon (politetrafluoroetileno), Kynar (fluoreto de polivinilideno) e teleeno (polidicciclopentadieno), são extremamente resistentes ao ataque de ácidos e corrosão.
Cerâmica
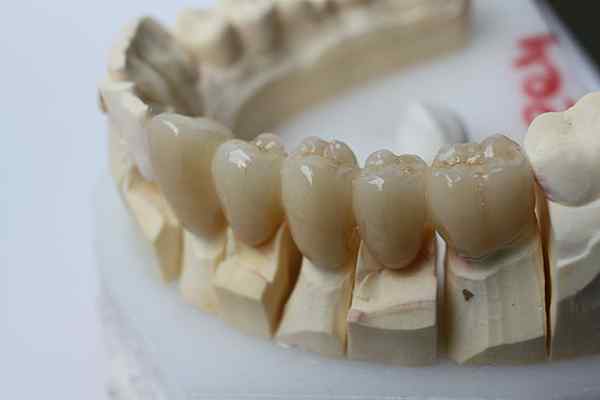 A inércia química da zircônia permite que ela seja usada para próteses dentárias. Fonte: Bin Im Garten via Wikipedia.
A inércia química da zircônia permite que ela seja usada para próteses dentárias. Fonte: Bin Im Garten via Wikipedia. A cerâmica inerte vai um passo além do que os plásticos. Eles são destinados a aplicações onde predominam altas temperaturas, bastante usuais na indústria automotiva e aeroespacial; ou em sistemas bioquímicos, como na indústria farmacêutica e na implementação de próteses ósseas.
Entre algumas dessas cerâmicas com grande inércia química, temos: Alumina (para2QUALQUER3, Presentes em Corindon e Sapphire), os silicatos (vidro especializado), carboneto de silício (sic, duro e tenaz) e zircônia (Zio2).
Gases inertes
Deixando de lado os materiais inertes, agora temos substâncias inertes. Os gases inertes não são muito reativos, portanto a presença deles no ar não implica nenhum risco de reação em condições normais.
Entre esses gases, temos o CO2, CO e n2. O nitrogênio é o mais inerte de todos esses gases; E, no entanto, ele é capaz de reagir quente com alguns metais para formar nituros, m3Nn, ser n Estado de oxidação de Valência ou Metal.
O co2 É relativamente inerte; Exceto quando atende a soluções alcalinas, onde é transformada em carbonatos ou na presença de enzimas anidraicas de carvão.
Por sua vez, o CO permanece inerte à temperatura ambiente; Mas em altas temperaturas, ele reage com carvão, vapor de água, óxidos de metal, olefinas, entre outros compostos.
Pode servir a você: Equilíbrio Químico: Explicação, Fatores, Tipos, ExemplosTais reações podem prosseguir na presença de catalisadores de metal. Da mesma forma, CO, mesmo sem quebrar suas ligações covalentes, é capaz de coordenar átomos de metal neutros.
Metais nobres
Os metais nobres são os mais resistentes à corrosão e ataque de ácidos e álcalis. Cada um, a altas temperaturas, ou em formato de poeira, reagirá com oxigênio ou fluoreto. Portanto, a inércia química desses elementos é bastante relativa.
Entre os metais nobres que temos: ouro (AU), Ruthenio (RU), Platinum (Pt), Paladio (PD), Osmio (OS) e Iridido (IR). De todos eles, o ouro é o mais nobre, sendo mesmo em um estado metálico na crosta terrestre.
gases nobres
E, finalmente, na sede mais alta de inércia química, temos gases nobres: hélio (He), neon (ne), argônio (AR), Crypton (KR), xenon (XE) e Radon (RN). Todos eles são extremamente inertes. No entanto, muitos compostos do xenônio foram sintetizados, incluindo sais conhecidos como Perxenatos, com o ânion Xeo64-.
 As luzes de neon correspondem aos elementos químicos mais inertes da natureza
As luzes de neon correspondem aos elementos químicos mais inertes da natureza Sua inércia química é porque seus átomos contêm suas camadas de energia e orbital totalmente cheias de elétrons. Do argônio, é possível que, sob as ultrappressões, eles acessem elétrons usando camadas orbitais vazias ou mais energia (3D e 4s, por exemplo); coisa que é impossível para hélio ou neon.
De gases nobres com precisão e neon são os mais inertes. O hélio é capaz de formar compostos com sódio a pressões muito altas (hena).
Enquanto isso, nenhum composto é conhecido, sendo ainda mais inerte do que o próprio Helium por causa de sua maior carga nuclear eficaz, que repele fortemente qualquer átomo que tenta se aproximar de átomos de neon.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química InorgánI Ca. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Quimicamente inerte. Recuperado de: em.Wikipedia.org
- Dr. Doug Stewart. (2020). Definição de inerte. Recuperado de: Chemicool.com
- Elsevier b.V. (2020). Inércia química. Cientedirect. Recuperado de: ScientEdirect.com
- Clara Moskowitz. (20 de março de 2018). Uma surpresa nobre de gás: o hélio pode formar compostos estranhos. Recuperado de: Scientific American.com
- Coorstek. (2020). Propriedades químicas da cerâmica técnica. Recuperado de: Coorstek.com
- Osborne Industries. (2020). Os 3 plásticos mais resistentes a ácidos. Recuperado de: Osborneindustries.com

