indiano

- 1695
- 273
- Melvin Mueller
 Peça indiana metálica. Fonte: imagens de alta resolução de elementos químicos [CC por (https: // criativeCommons.Org/licenças/por/3.0)]
Peça indiana metálica. Fonte: imagens de alta resolução de elementos químicos [CC por (https: // criativeCommons.Org/licenças/por/3.0)] O que é o indiano?
Ele indiano É um metal que pertence ao grupo 13 da tabela periódica e tem um símbolo químico em. Seu número atômico é 49, 49Em e é apresentado na natureza como dois isótopos: 113dentro e 115Em, este último sendo o mais abundante. Na Terra, os átomos indianos são encontrados como impurezas nos minerais de zinco e chumbo.
É um metal em particular, pois é o mais suave que pode ser tocado sem muitos riscos à saúde; Ao contrário do lítio e rubidium, o que queimaria a pele terrivelmente ao reagir com sua umidade. Um pedaço de índio pode ser cortado com uma faca e fratura com a força dos dedos, emitindo uma crise distinta.
Quem ouve sobre esse metal certamente virá à mente da Índia, mas seu nome deriva da cor índigo, que é observada quando o teste de chama é realizado. Nesse sentido, parece muito potássio, queimando seu metal ou seus compostos com uma chama muito característica, através da qual o índio foi detectado pela primeira vez em minerais de esfera.
O indiano compartilha muitas qualidades químicas com alumínio e gálio, apresentando na maioria dos compostos com um número de oxidação de +3 (em3+). Combina excelentemente com as ligas da formação de Gália com pontos de fusão baixos, sendo um deles o Galinstan.
As aplicações indianas são baseadas no revestimento de materiais com suas ligas, tornando -as condutores elétricos e flexíveis. O índio tem algum copo para conceder -lhes maiores brilhos, substituindo a prata. No mundo da tecnologia, o indiano é encontrado nas telas de toque e LCD.
Descoberta
Em 1863, o químico alemão Ferdinand Reich estava procurando traços do elemento Talio, usando a linha verde de seu espectro de emissão, em minerais de Cinc; Especificamente amostras de esfalerita (ZnS) em torno da Saxônia. Depois de brindar os minerais, remova seu teor de enxofre, digeri -los em ácido clorídrico e destilar o cloreto de zinco, obteve um precipitado de pajizo.
Dada a descoberta, Reich decidiu realizar uma análise espectroscópica; Mas porque ele não tinha bons olhos para observar as cores, ele foi ao seu colega Hariomus Theodor Richter para ajudá -lo nesta tarefa. Richter foi quem observou uma linha espectral azulada, que não correspondia ao espectro de nenhum outro elemento.
Pode atendê -lo: Iodose ácido (hio2): propriedades e usosOs dois químicos alemães estavam enfrentando um novo elemento, chamado de cor indiana para a cor índigo da chama quando seus compostos queimavam; E por sua vez, o nome desta cor deriva da palavra latina Indicum, O que a Índia significa.
Um ano depois, em 1864, excitado e depois de uma série prolongada de chuvas e purificações, eles isolaram uma amostra de indiano metálico através da eletrólise de seus sais dissolvidos na água.
Estrutura indiana
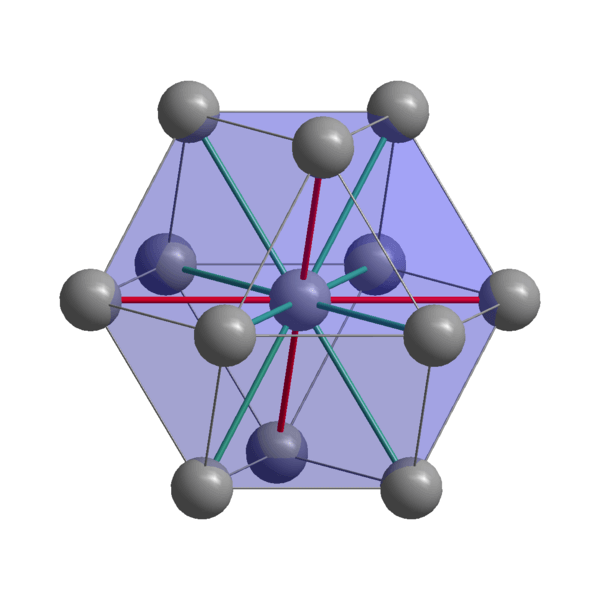 Estrutura cristalina indiana
Estrutura cristalina indiana Indian, in, átomos de coesão usando seus elétrons de valência para estabelecer uma ligação metálica. Assim, eles acabam sendo ordenados em uma estrutura tetragonal distorcida centrada no corpo. As interações entre os átomos no vizinho são relativamente fracos, o que explica por que o indiano tem um ponto de fusão baixo (156 ºC).
Por outro lado, as forças que unem dois ou mais cristais indianos também não são fortes, caso contrário, não se moveriam um para o outro, conferindo a suavidade característica do metal.
Propriedades indianas
Aparência física
É um metal prateado notavelmente macio. Pode rasgar com a pressão da unha, cortar com uma faca ou arranhar em traços brilhantes em uma folha de papel. É até possível mastigá -lo e deformá -lo com os dentes, desde que seja achatado. Também é muito dúctil e maleável, com propriedades plásticas.
Quando o índio aquecido com uma tocha descarta uma chama de cor índigo, até mais brilhante e mais colorida que a do potássio.
Massa molar
114,81 g/mol
Ponto de fusão
156.60 ºC
Ponto de ebulição
2072 ºC.
Como a Gália, o índio tem um grande intervalo de temperatura entre seu ponto de fusão e a ebulição. Isso reflete o fato de que as interações dentro do líquido são mais fortes do que as que predominam no vidro; E, portanto, é mais fácil obter uma gota de indiano do que seus vapores.
 Localização indiana na tabela periódica. Fonte: Daniel Mayer ou Greatpatton Vectorização: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons
Localização indiana na tabela periódica. Fonte: Daniel Mayer ou Greatpatton Vectorização: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons Densidade
À temperatura ambiente: 7,31 g/cm3
Bem no ponto de fusão: 7,02 g/cm3
Eletro-negatividade
1,78 na escala Pauling
Energias de ionização
Primeiro: 558,3 KJ/mol
Segundo: 1820,7 KJ/mol
Terceiro: 2704 KJ/mol/mol
Condutividade térmica
81,8 W/(M · K)
Resistividade elétrica
83,7 nω · m
Dureza mohs
1.2. É pouco mais difícil do que o talco (não confundindo a tenacidade com força).
Reatividade
Os indianos se dissolvem em ácidos para causar sais, mas não se dissolvem em soluções alcalinas, mesmo com hidróxido de potássio quente. Reage em contato direto com enxofre, oxigênio e halogênios.
Pode servir a você: diluição: conceito, como é feito, exemplos, exercíciosO índio é relativamente anfotérico, mas se comporta mais como base do que como ácido, sendo suas soluções aquosas ligeiramente básicas. O in (oh)3 É redisolve com a adição de mais álcalis causando complexos indiados, em (OH)4-, Como nos aluminatos.
Configuração eletronica
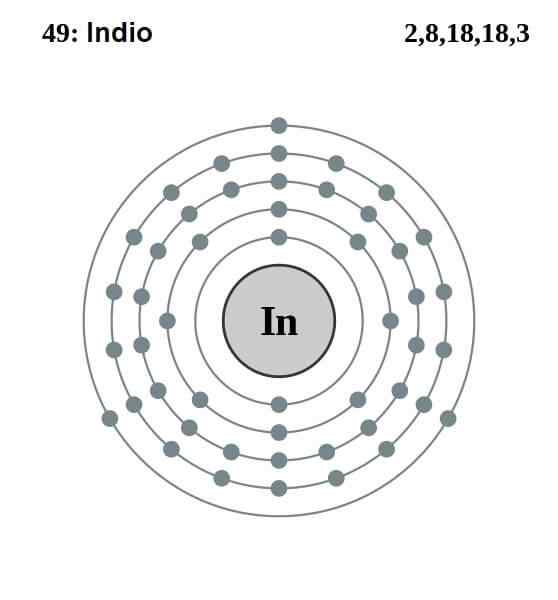 Configuração eletrônica indiana
Configuração eletrônica indiana A configuração eletrônica do índio é a seguinte:
[KR] 4D10 5s2 5 p1
Desses treze elétrons, os últimos três dos orbitais 5s e 5p são os de Valência. Com esses três elétrons, os átomos indianos estabelecem sua ligação metálica, como o alumínio e o gálio, e formam ligações covalentes com outros átomos.
Números de oxidação
O acima é usado para suportar imediatamente que o índio é capaz de perder seus três elétrons de Valência ou ganhar cinco para se tornar isoletrônico a nobre xenônio a gás.
Se em um composto, assumimos que ele perdeu seus três elétrons, ele permanecerá como o cátion trivalente em3+ (Em analogia al3+ e ga3+) e, portanto, seu número de oxidação será +3. A maioria dos compostos indianos está em (iii).
Entre outros números de oxidação encontrados para o indiano que temos: -5 (em5-), -2 (em2-), -1 (em-), +1 (em+) e +2 (em2+).
Alguns exemplos de compostos em (i) são: inf, incl, inbr, ini e em2QUALQUER. Todos eles são compostos relativamente raros, enquanto os de (iii) são predominantes: em (oh)3, Em2QUALQUER3, Incl3, Inf3, etc.
Em (i) compostos são agentes redutores poderosos, nos quais o no+ doar dois elétrons para outras espécies para se tornar3+.
Isótopos
O índio é apresentado na natureza como dois isótopos: 113dentro e 115Em cujas abundâncias de terra são 4,28% e 95,72%, respectivamente. Portanto, na Terra, temos muito mais átomos de 115No de 113Em. Ele 115In tem meia -vida de 4,41 · 1014 anos, tão bom que é praticamente considerado estável, apesar de ser um radioisótopo.
Atualmente, um total de 37 isótopos artificiais do indiano, todos radioativos e muito instáveis foram criados. De todos eles, o mais estável é o 111Em, que tem meia -vida de 2,8 dias.
Usa/aplicações
Ligas
O índio se dá muito bem com o gálio. Ambos os metais formam ligas que Mel. Além disso, o indiano também é facilmente amálgamo, com uma solubilidade de 57% em mercúrio.
Pode atendê -lo: ácido acético (CH3cooh)As ligas indianas são usadas para projetar espelhos de prata sem recorrer à prata. Quando são derramados em uma área de qualquer material, ele atua como um aderente, de modo que vidro, metal, quartzo e cerâmica podem ser coletados.
eletrônicos
 Sem o indiano, as telas de toque nunca teriam existido
Sem o indiano, as telas de toque nunca teriam existido O índio também se dá bem com o Germanio, então seus compostos são adicionados como doping ao nitruro germânico dos LEDs, reproduzindo essas misturas luzes azuis, roxo e verde. Também faz parte dos transistores, termistores e células fotovoltaicas.
O mais importante de seus compostos é a lata e o óxido indiano, que é usado como forro de vidro para refletir alguns comprimentos de onda. Isso permite que você seja usado em copos de solda e no vidro de arranhão para que eles não aqueçam dentro.
O vidro revestido com este óxido são bons condutores de eletricidade; Como o dos nossos dedos. E é por isso que está destinado à fabricação de telas de toque, ainda mais atividades atuais devido ao surgimento de cada vez mais smartphones.
Riscos
 Indiano em estado sólido. Fonte: w. Oelen, CC BY-SA 3.0, via Wikimedia Commons
Indiano em estado sólido. Fonte: w. Oelen, CC BY-SA 3.0, via Wikimedia Commons O índio não representa nenhum risco para o meio ambiente em primeira instância, pois está em íons em3+ Eles não são disseminados em quantidades apreciáveis. Não há informações sobre qual seria seu impacto nos solos, afetando plantas, e nem na fauna ou mar.
No corpo, não se sabe se os íons em3+ Eles têm alguma participação essencial no metabolismo em valores de traços. No entanto, quando seus compostos são ingeridos, eles são prejudiciais a vários órgãos, e é por isso que são considerados substâncias altamente tóxicas.
De fato, partículas ITO (estanho e óxido indiano, por seu acrônimo em inglês: Óxido de lata de índio), indispensável para a fabricação de telas para computadores e smartphones, eles podem afetar negativamente a saúde dos trabalhadores, causando -lhes uma doença chamada pulmões indianos.
A ingestão dessas partículas ocorre acima de tudo pela inalação e pelo contato através da pele e dos olhos.
Por outro lado, as partículas indianas metálicas finas são propensas a queimar e causar incêndios se forem cercas uma fonte de calor.

