Estrutura de hidróxido de ferro (ii), propriedades, usos
- 1859
- 135
- Mr. Reginald Lindgren
Ele hidróxido de ferro (ii), Também chamado de hidróxido ferroso, é um composto inorgânico de fórmula química da fé (OH)2. Se sua pureza é alta, seu sólido é composto apenas de íons de fé2+ e oh- Em um relacionamento 2: 1; No entanto, moléculas de água e espécies iônicas diferentes podem conter, mudando a posição.
Representa a forma "reduzida" da famosa superfície de ferrugem, avermelhada composta por íons de fé3+; Enquanto estava em ferrugem esverdeada, a fé predomina2+, próximo ah- E outra quantidade de ânions: co32-, SW42-, NÃO3- e haluros (F-, Cl-,… ), por exemplo. O resultado, embora a base dessa ferrugem verde seja fé (oh)2, é que vários sólidos são obtidos.
 Óxido verde na superfície do ferro: material de origem deste tipo de hidróxido. Fonte: Pixabay.
Óxido verde na superfície do ferro: material de origem deste tipo de hidróxido. Fonte: Pixabay. Na vida cotidiana, esse hidróxido pode ser contemplado em lugares comuns. Por exemplo, o navio de imagem superior tem sua superfície coberta de ferrugem verde (não pátina). Existe a fé (oh)2, mas acompanhado por numerosos íons das ondas do mar.
Quimicamente falando, as propriedades e os usos desse material dependem do cátion fé2+ e de sua tendência a oxidar para se transformar em fé3+. É um agente redutor, que reage rapidamente com oxigênio em condições básicas. Portanto, deve ser usado em atmosferas inertes e soluções de ácido.
[TOC]
Estrutura de hidróxido de ferro (ii)
Links
Considerando apenas fé (oh)2 Puro, não há nada mais íons de fé2+ e oh-.
As interações entre eles devem ser, em teoria, da natureza iônica; Cada fé fé2+ atrai dois ânions oh-, cujas atrações não dirigidas acabam estabelecendo uma ordem estrutural e repetitiva que define um cristal; por sua vez, dá origem ao pó de ferrugem verde.
Pode servir você: hidróxido de zinco (Zn (OH) 2)O problema é que existe um certo caráter covalente entre os dois íons e, portanto, um link iônico de Fe-oh não pode ser ignorado. Considerando um link parcialmente iônico de Fe-oh, pode-se entender que eles são agrupados em uma espécie de camada polimérica.
Dupla camadas de hidróxido
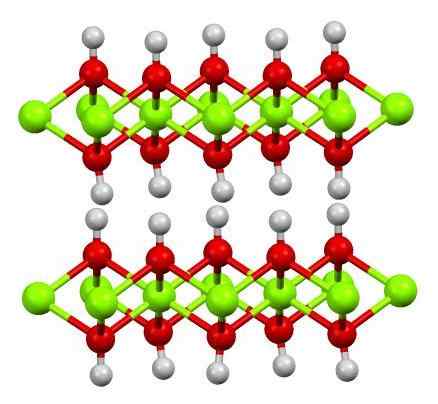
 Estrutura da fé (OH) 2. Fonte: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Estrutura da fé (OH) 2. Fonte: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] A estrutura de hidróxido ferroso puro com um modelo de esferas e barras é mostrado acima. Cátions Fe2+ Eles são representados pelas esferas verdes de Chillón, enquanto os ânions oh- Para as esferas vermelhas e brancas. Observe como os íons fé estão alinhados2+ Graças às interações (covalentes iônicos) com o OH-.
Por que essa estrutura são duplas de hidróxido? A própria imagem oferece a resposta: existem duas linhas ou camadas de oh- Para cada fé2+; isto é, a proporção 2: 1 de fé (OH) é mantida2 mencionado no começo.
Unidades estruturais para fé (OH)2 Eles são então esses sanduíches, onde as camadas de Oh- Eles viriam representar os pães; pão carregado negativamente e isso, portanto, falha em consertar um cristal marrom impressionante.
Mas, por outro lado, os átomos de H também estão alinhados e eclipse. Lembrando o conceito de polaridade e eletronegatividade, esses hidrogênios têm uma leve carga parcial positiva, Δ+; o que, embora fraco, pode ter uma área positiva onde outros ânions ou moléculas estão alojados.
Hidrata
Quando fé (oh)2 Ele se dissolve na água, suas moléculas coordenam com o centro de fé metal2+ Para formar uma ACU complexa: [fé (h2QUALQUER)4(OH)2]. Este complexo tem uma geometria octaédrica para ter seis ligantes: quatro moléculas de água e dois oh-. No entanto, em hidróxido ferroso, o panorama é um pouco diferente.
Pode atendê -lo: Lei sobre a conservação da matériaEm hidrato, fórmula hipotética Fe (OH)2· NH2Ou, as moléculas de água são alojadas exatamente entre as duas camadas de hidróxido; isto é, eles interagem através de forças de íons dipolares com hidrogênios ou esferas brancas. É como se duas partidas de Ohfeoh fossem agarradas e a água foi intercalada para agrupar -as: Ohfeoh (H2O) Ohfeah.
As moléculas de água são muito dinâmicas, impedindo que partículas de hidrato adquiram tamanhos consideráveis e, consequentemente, formem uma sólida coloidal ou geléia.
Ferrugem verde e vermelha
Em hidratos, as camadas de hidróxido têm moléculas de água intercaladas; No entanto, eles podem ter outros ânions (já mencionados), causando uma grande variedade de arenques verdes. Eles também podem "capturar" moléculas tão grandes quanto o DNA, ou drogas.
Os íons fé não apenas podem estar presentes2+, mas também fé3+, Produto da oxidação interna causada por oxigênio intercalado. Visivelmente, observaria -se que a ferrugem verde (óxido em U) começa a ficar avermelhado à medida que a concentração de fé aumenta3+.
Propriedades
 Tubo de ensaio com hidróxido ferroso na água. Fonte: Chemicalintest [Domínio Público]
Tubo de ensaio com hidróxido ferroso na água. Fonte: Chemicalintest [Domínio Público] Fé (oh) é mostrada acima2 precipitar em um tubo de ensaio. Estando em água abundante, a ACU complexa deve predominar acima da estrutura recém -mencionada. Observe que a superfície parece uma cor laranja, como resultado da oxidação da fé2+ para a fé3+ para o oxigênio do ar; Ou seja, este hidróxido é um agente redutor:
Fé2+ Fé3+ + e-
A aparência física deste composto em seu estado mais puro é o de um sólido marrom:
 Hidróxido ferroso puro. Fonte: Ondřej Mangl [Domínio Público]
Hidróxido ferroso puro. Fonte: Ondřej Mangl [Domínio Público] O que, dependendo do seu nível de umidade, pode ser apresentado como um sólido com gelatina. É bastante insolúvel em água (ksp= 8 · 10-16 e solubilidade = 0,72 g/100ml a 25ºC) e possui uma massa molar de 89,86 g/mol e uma densidade de 3,4 g/ml.
Pode atendê -lo: os 20 tipos de química e sua desnificaçãoNão são relatados um ponto de fervura ou fusão para este composto; Provavelmente, devido ao fato de que, antes de uma fonte de calor, ela fica desidratada e se converte em óxido ferroso, feio:
Fé (oh)2 => Feio + h2QUALQUER
Formulários
Análise qualitativa orgânica
Seu poder redutor é usado para determinar a presença de compostos nitro, RNO2. A reação para a qual um teste positivo é obtido é representado com a seguinte equação química:
Rno2 + 6fe (OH)2 + 4h2O => RNH2 + 6fe (OH)3
A fé (oh)3 precipita como um sólido marrom -redizo, que certifica a presença do grupo nitro, -no2.
Redutor de oxoaniões de selênio
O poder redutor da fé (oh)2 Também usou para reduzir os ânions de SEO32- (Selenito) e SEO42- (selenato) para o selênio elementar,. Praticamente, permite a remoção de tais ânions, prejudiciais à saúde, na forma de um sólio de selênio insolúvel e facilmente removível.
Materiais de duas camadas
Sua estrutura pura e ferrugem verde é uma fonte de inspiração para o design de novos materiais de características mineralógicas.
Estima -se que a função destes permite o transporte de uma espécie específica entre suas camadas, de tal maneira que sua libertação possa ser controlada ou reduzida ao local ativo (solos, células, superfície de metal etc.).
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Ferro (ii) hidróxido. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). Hidróxido ferroso. Banco de dados PubChem. CID = 10129897. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Nick Doe. (s.F.). Testes para grupos fenóis e nitro. Química 211. Recuperado de: acadêmicos.Wellesley.Edu
- Clark Jim. (27 de abril de 2019). Química do Ferro. Química Librettexts. Recuperado de: química.Librettexts.org
- Kingston Technical Software. (2019). Química da ferrugem. Médicos de corrosão. Recuperado de: Dotores de Corrosão.org
- Zingaro, Ralph A. et al. (1997). Redução de ânions de oxosseelénio por hidróxido de ferro (ii). Ambiente Internacional. 23 (3): 299-304. Doi: 10.1016/S0160-4120 (97) 00032-9
- « Propriedades do óxido de cloro (v), estrutura, usa
- Propriedades do óxido de cloro (iii), estrutura, usa »

