Propriedades do óxido de cloro (v), estrutura, usa

- 2604
- 134
- Gilbert Franecki
Ele Óxido de cloro (V) É um composto inorgânico altamente instável cuja fórmula química é cl2QUALQUER5. É um dos muitos óxidos de cloro, que são caracterizados por serem moleculares ou mesmo espécies radicais.
O cl2QUALQUER5 Ele só encontrou a vida no papel e nos cálculos teóricos; No entanto, sua existência não foi descartada e é provável que alguns possam ser caracterizados (por técnicas avançadas de espectroscopia)))). O que, devido a conceitos gerais de química, pode ser previsto para esse óxido, é que é o anidrido do ácido clorico, HCLO3.
 Molécula Cl2O5. Fonte: Jynto [CC0].
Molécula Cl2O5. Fonte: Jynto [CC0]. A molécula hipotética de óxido de cloro (V) é mostrada acima (v). Observe que porque é uma molécula, a presença do CL+5; Ainda menos quando ele deve ter um poder tão polarizador para forçar o oxigênio, ligando covalentemente.
Como qualquer composto instável, libera energia para decompor em produtos mais estáveis; processo que em muitos casos é explosivo. Quando o cl2QUALQUER5 Quebra a liberdade2 EU2. É teorizado que na água, dependendo do isômero de CL2QUALQUER5, Vários oxoácidos de cloro podem ser formados.
[TOC]
Propriedades
A massa molar do CL2QUALQUER5 é 150.9030 g/mol. A partir dessa massa e sua molécula hipotética, pode -se conjeturar que, se puder ser isolado, provavelmente seria um líquido oleoso; Claro, comparando -o com a aparência física do CL2QUALQUER7.
Embora não possa ser isolado ou caracterizado, esse óxido de cloro é ácido, covalente e também deve ter um pequeno momento dipolar. Sua acidez é compreensível se a equação química de sua hidrólise for analisada:
Pode servir a você: Lei de Amagat: Explicação, Exemplos, ExercíciosCl2QUALQUER5 + H2Ou 2HCLO3
Sendo o HCLO3 O ácido clorico. A reação reversa resultaria no caso de o ácido pode ser desidratado:
2HCLO3 => Cl2QUALQUER5 + H2QUALQUER
Por outro lado, quando o CL2QUALQUER5 Assim que ocorre, se decompõe:
2cl2QUALQUER5 => 4ClO2 + QUALQUER2
É, portanto, uma espécie intermediária em vez de um óxido corretamente falando. Sua decomposição deve ser tão rápida (considerando que o CL é formado2QUALQUER5), que não pôde ser detectado pelas técnicas atuais de análise instrumental.
Estrutura de óxido de cloro (V)
Molécula
Na imagem superior, a estrutura da molécula hipotética Cl foi mostrada2QUALQUER5 Com um modelo de esferas e bares. Esferas vermelhas representam átomos de oxigênio e verde para cloro. Cada cloro tem um ambiente de pirâmide trigonal, então sua hibridação deve ser SP3.
Assim, a molécula Cl2QUALQUER5 Pode ser visto como duas pirâmides trigonais ligadas por um oxigênio. Mas se for cuidadosamente observado, uma pirâmide guia seus átomos de oxigênio para baixo e o outro para fora do plano (na direção do leitor).
Daqui, presume -se que há rotações no link ou2Cl-o-Cl2, tornando a molécula relativamente dinâmica. Observe que a fórmula ou2Cloclo2 É uma maneira de representar a estrutura do CL2QUALQUER5.
Estrutura de Lewis
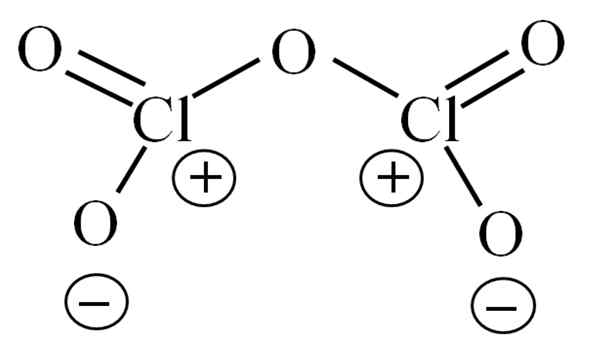 Estrutura de Lewis para o hipotético Cl2O5. Fonte: Gabriel Bolívar.
Estrutura de Lewis para o hipotético Cl2O5. Fonte: Gabriel Bolívar. Até agora, a própria molécula não permitiu decifrar qual é a sua instabilidade devido. Para esclarecer essa questão, sua estrutura de Lewis é usada, representada acima. Observe que pode -se pensar erroneamente que a estrutura é plana, mas na sub -seção anterior foi esclarecido que não é assim.
Pode atendê -lo: sódio azid (nan3): estrutura, propriedades, usos, riscosPor que ambos os átomos de cloro têm cargas formais positivas? Como o cloro tem um par livre de elétrons, que podem ser verificados quando a teoria do link de Valência é aplicada (que devido à simplificação não será feita aqui). Assim, sua carga formal é:
CF = 7 - (4 + 2) = 1
E o que isso tem a ver com sua instabilidade? Bem, o cloro é consideravelmente eletronegativo e, portanto, um portador ruim de cargas formais positivas. Isso retorna ao CL2QUALQUER5 Uma espécie extremamente ácida, pois precisa ganhar elétrons para fornecer a demanda eletrônica dos dois cloros.
O oposto acontece com o BR2QUALQUER5 e o i2QUALQUER5, óxidos que existem em condições normais. Isso ocorre porque o bromo e o iodo são menos eletronegativos que o cloro; E, portanto, eles apóiam a carga formal positiva melhor.
Isômeros e sua respectiva hidrólise
Até agora, toda a explicação caiu para um dos dois isômeros do CL2QUALQUER5: O o2Cloclo2. Qual é o outro? O o3Cloclo. Neste isômero, os cloros não têm cargas formais positivas e, portanto, devem ser uma molécula mais estável. No entanto, tanto o ou2Cloclo2 Como o O3Cloclo deve sofrer reações de hidrólise:
QUALQUER2Cl-o-Cl2 + H2O => 2º2Cl-oh (que nada mais é do que o HCLO3)
QUALQUER3CL-O-CLO + H2O => o3CL-OH (HCLO4) + Ho-Clo (HCLO2)
Observe que até três oxoácidos de cloro podem ser formados: HCLO3, HCLO4 E HCLO2
Nomenclatura
Seu nome 'óxido de cloro (v)' corresponde ao atribuído de acordo com a nomenclatura de ações. O cl2QUALQUER5 Também pode ter outros dois nomes: dicloro e cloring anidrido pentaxido, atribuído por nomenclaturas sistemáticas e tradicionais, respectivamente, respectivamente.
Pode atendê -lo: titânio: história, estrutura, propriedades, reações, usosFormulários
Mais do que motivar estudos de computador, o CL2QUALQUER5 Faltará uso até que seja descoberto, isolado, caracterizado, armazenado e mostrou que ele não explodiu ao menor contato.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Sandra Luján Quiroga e Luis José Perissinotti. (2011). Oxoácidos de cloro e estrutura de óxidos de dicloros. Chem. Educator, vol. 16.
- Formulação química. (2019). Óxido de cloro (V). Recuperado de: formulação Quimica.com
- Linus Pauling. (1988). Química Geral. Dover Publications, Inc., Nova Iorque.
- Richard c. ROPP. (2013). Enciclopédia dos compostos da Terra Alcalina. Elsevier.
- « Antecedentes e características do neolamarckismo
- Estrutura de hidróxido de ferro (ii), propriedades, usos »

