Estrutura de hidreto de alumínio (ALH3), propriedades, usos
- 1480
- 312
- Melvin Mueller
Ele Hidreto de alumínio É um composto inorgânico cuja fórmula química é ALH3. Embora pareça de uma natureza simples, é realmente uma substância um tanto complexa. Devido ao brilho cristalino que pode ocorrer em seu sólido, geralmente é tomado como um hidreto iônico, formado por íons para o3+ e h-.
No entanto, suas propriedades demonstram o contrário: é um sólido polimérico, cuja representação mais fiel seria do tipo (Alh3)n, ser n O número de unidades monoméricas ALH3 que integraria uma corrente de vidro ou camada. Portanto, o ALH3 É um daqueles polímeros que consegue adotar uma estrutura cristalina.
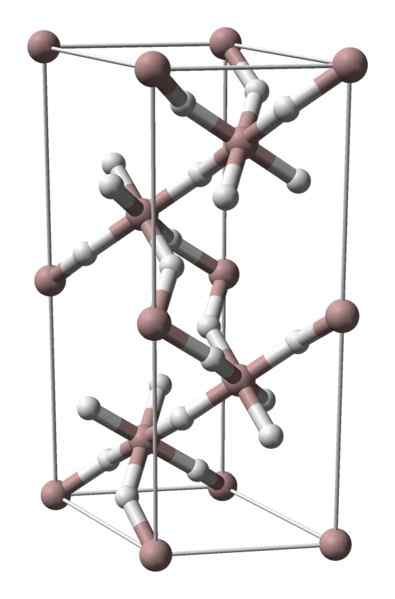 Estrutura cristalina de hidreto de alumínio. Fonte: Benjah-BMM27 / Domínio Público
Estrutura cristalina de hidreto de alumínio. Fonte: Benjah-BMM27 / Domínio Público O hidreto de alumínio não é sólido com muita difusão comercial; portanto, as imagens disponíveis são escassas. É especialmente usado para síntese orgânica, onde serve como um agente redutor poderoso. Ele também ocupa um lugar especial no avanço tecnológico dos materiais, sendo uma alternativa promissora para o armazenamento de hidrogênio.
Este composto, também chamado Alano, mantém um relacionamento próximo com o Lialh4, cujos nomes são alumínio e hidreto de lítio, alanato de lítio ou tetra -hidroaluminação de lítio. Embora tenha características de polímero e uma metaestabilidade térmica, ocorre em sete polimorfos com diferentes morfologias cristalinas.
[TOC]
Estrutura
Coordenações
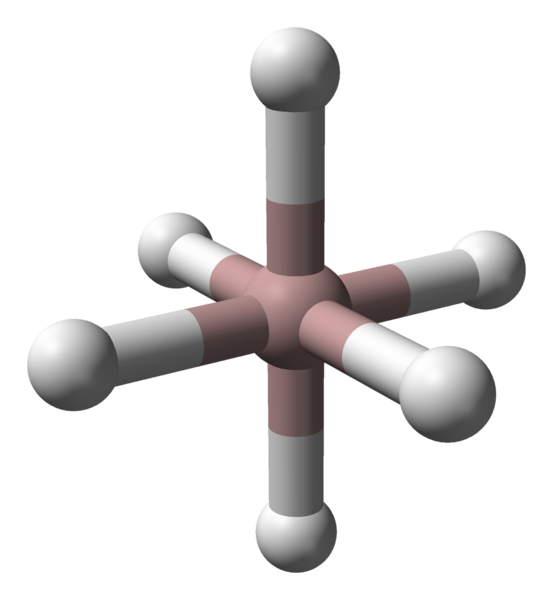
 Coordenação octaédrica de cátions de alumínio no cristal ALH3. Fonte: Benjah-BMM27 / Domínio Público.
Coordenação octaédrica de cátions de alumínio no cristal ALH3. Fonte: Benjah-BMM27 / Domínio Público. Independentemente do polimorfo ou da fase cristalina considerada, a coordenação entre os átomos de alumínio e hidrogênio é constante. Na imagem superior, por exemplo, como na primeira imagem, o octaedro de coordenação para átomos de alumínio (esfera marrom) é mostrada na primeira imagem.
Pode atendê -lo: leis estequiométricasCada átomo é cercado por seis h, estabelecendo seis links al-h. A maneira pela qual os octaedros são orientados no espaço farão a diferença estrutural entre um polimorfo e outro.
Por outro lado, cada átomo de H é coordenado com dois átomos AL, estabelecendo uma ligação al-h-al, que pode ser justificada por um link do tipo 3C2E (3 centros-2 elétrons). Este link é responsável por ingressar em vários octadros alh6 em todo o cristal Alano.
Molécula isolada
O Alh3 É considerado polimérico por causa das redes ALH6 que integram o vidro. Para isolar uma molécula de alano individual, é necessário aplicar baixas pressões em uma atmosfera inerte de gás nobre. Dessa forma, o polímero quebra e libera moléculas de ALH3 de geometria plana trigonal (análoga a BH3).
Por outro lado, é possível diminuir dois Alh3 para formar a2H6, Como no diborano, B2H6. No entanto, para conseguir isso, o uso de hidrogênio sólido é necessário, portanto, pode não ter muito valor industrial ou comercial de longo prazo.
Polymorphs
O Alano ou Alh3 É capaz de formar até sete polimorfos: α, α ', β, γ, δ, ε e ζ, dos quais α é a mais estável para alterações de temperatura. O α-ARH3 É distinguido por ter uma morfologia cúbica e uma estrutura cristalina hexagonal. Tende a ser o produto no qual os outros polimorfos são transformados quando sofrem desestabilização térmica.
A morfologia de γ-ARH3, Por outro lado, se destaca por ser do tipo de agulhas. É por isso que o ALH3 o sólido pode conter uma mistura de mais de dois polimorfos e apresentar cristais variados ao microscópio.
Propriedades
Aparência física
A hidreto de alumínio é uma aparência solidária incolor ou esbranquiçada e cristalina, com uma tendência a mostrar formas de agulha.
Pode atendê -lo: ácido sulfônico: estrutura, nomenclatura, propriedades, usosMassa molar
29.99 g/mol o 30 g/mol
Ponto de fusão
150 ºC. Mas começa a quebrar de 105 ° C.
Solubilidade em água
Alto, depois reaja com ela.
Solubilidade
Insolúvel em solventes de dietiléter e apolar, como benzeno e pentan. Reage com álcoois e outros solventes polares.
Decomposição
O Alh3 É suscetível a decompor em diferentes velocidades, dependendo das condições externas, da morfologia e da estabilidade térmica de seus cristais, ou do uso de catalisadores. Quando isso acontece, libera hidrogênio e se transforma em alumínio de metal:
2Ar3 → 2al + 3h2
De fato, essa decomposição, em vez de ser um problema, representa uma das razões pelas quais o Alano é considerado interessante no desenvolvimento de novas tecnologias de energia.
Formação de aductos
Quando o Alh3 Não reage com o solvente irreversivelmente, estabelece um aduto com ele, ou seja, um tipo de complexo. Por exemplo, você pode formar um complexo com trimetilamina, Alh3· 2n (CHO3)3, Com o tetra -hidrofurano, Alh Alh3· THF, ou com Dietileter, Alh3· Et2QUALQUER. Este último era o mais conhecido quando a síntese ou a obtenção do Alano foi introduzida em 1947.
Obtenção
As primeiras aparições do Alh3 Eles datam de 1942 e 1947, sendo neste ano passado, quando sua síntese foi apresentada usando Lialh4 Em um meio dietil:
3Lialh4 + Alcl3+ nEt2O → 4ArH3 · nEt2O + 3licl
A solução etérea, Alh3 · nEt2Ou, ele teve que se submeter a decepcionar, com o objetivo de eliminar o ET2Ou e pegue o ALH3 puro. Além desse problema, o LiCl deve ser eliminado do meio dos produtos.
Assim, de 1950 a 1977, a nova síntese foi projetada para obter melhores rendimentos de ALH3, bem como sólidos mais puros e melhores propriedades térmicas e morfológicas. Modificando as quantidades, etapas e instrumentos utilizados, é possível favorecer a obtenção de um polimorfo acima do outro. No entanto, α-A-AH3 Geralmente é o produto majoritário.
Pode atendê -lo: Alilo: unidade allyic, carbocalização, radical, exemplosOutros métodos de síntese consistem em fazer uso da eletroquímica. Para fazer isso, um ânodo de alumínio e um cátodo de platina são usados. No ânodo, a seguinte reação passa:
3aH4- + Para o3+ + nThf → 4aH3 · nThf + 3e-
Enquanto no cátodo o sódio metálico é obtido. Então o Alh3 · nTHF também sofre de desiludir a eliminar o THF e finalmente obter o Alh3.
Formulários
Agente redutor
O Alh3 Serve para reduzir certos grupos funcionais de compostos orgânicos, como ácidos carboxílicos, cetonas, aldeídos e ésteres. Praticamente, o que faz é adicionar hidrogênios. Por exemplo, um STER pode ser reduzido a um álcool na presença de um grupo nitro:
 Redução de um STER com hidreto de alumínio. Fonte: gengibre / domínio público.
Redução de um STER com hidreto de alumínio. Fonte: gengibre / domínio público. Reservatório de hidrogênio
O hidreto de alumínio representa uma alternativa para servir como um reservatório de hidrogênio e, portanto, ser capaz de dispensá -lo portablamente em dispositivos que operam com baterias de hidrogênio. Os volumes obtidos de H2 corresponde a um volume maior de duplo que Alh3.
Tendo o Alh3, e decompando -o controlado, uma certa quantidade desejável de h pode ser liberada2 em qualquer momento. Portanto, pode ser usado como combustível de foguete e todas as aplicações de energia que buscam tirar proveito da combustão de hidrogênio.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Alumínio de hidreto. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2020). Alumínio de hidreto. Banco de dados PubChem., CID = 14488. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- J. Graetz et al. (2011). Hidreto de alumínio como material de armazenamento de hidrogênio e energia: passado, presente e futuro. Elsevier b.V.
- Xu Bo et al. (2014). Preparação e propriedades térmicas dos polimorfos de hidreto dos alunos. doi.org/10.1016/j.Vácuo.2013.05.009
- « Conceito de variação linear, exemplos, exercício resolvido
- Forma da Terra e suas consequências físicas e astronômicas »

