História do Fósforo, Propriedades, Estrutura, Obtenção, Usos

- 942
- 74
- Melvin Mueller
Ele corresponder É um elemento não -metálico que é representado pelo símbolo químico P e possui número atômico 15. Apresenta três formas almotrópicas principais: fósforo branco, vermelho e preto. O fósforo branco é fosforescente, queima espontaneamente quando exposto ao ar e também é altamente venenoso.
O fósforo branco a 250 ° C de temperatura se torna fósforo vermelho; uma forma polimérica, insolúvel e isso não queima no ar. Em altas temperaturas e pressões, bem como na presença ou não em catalisadores, é obtido fósforo preto, que se assemelha a grafite e é um bom condutor de eletricidade.
 Fósforo branco armazenado em uma garrafa com água. Fonte: w. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Fósforo branco armazenado em uma garrafa com água. Fonte: w. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] O fósforo foi isolado pela primeira vez por H. Marca, em 1669. Para fazer isso, a urina usada como fonte desse elemento. Em 1770, W. Scheele descobriu que também podia isolar o fósforo ósseo.
Posteriormente, devido à criação do forno elétrico por J. Burgess Readman (1800), as rochas de fosfato se tornaram a principal fonte de produção de fósforo a partir de minério de fluoroapatita, presente neles.
O fósforo é o elemento doze mais abundante da crosta terrestre e representa 0,1% dele em peso. Além disso, é o sexto elemento em abundância no corpo humano; concentrado principalmente em ossos na forma de hidroxilapatita.
Portanto, é um elemento essencial para os seres vivos, tornando -se um dos três principais nutrientes das plantas. O fósforo faz parte da estrutura química dos ácidos nucleicos; de compostos de armazenamento de energia (ATP), coenzimas; e em geral, dos compostos do metabolismo.
[TOC]
História
- Descoberta
Na urina
 Joseph Wright, da pintura de Derby, onde a descoberta de fósforo ilustra. Fonte: Joseph Wright, de Derby [Domínio Público]
Joseph Wright, da pintura de Derby, onde a descoberta de fósforo ilustra. Fonte: Joseph Wright, de Derby [Domínio Público] O fósforo foi isolado pela marca Henning em 1669, sendo o primeiro humano a isolar um elemento. Brand era um alquimista alemão de Hamburgo e conseguiu obter um composto de fósforo da urina. Para fazer isso, ele reuniu a urina de 50 baldes e permitiu que ele se decomponha.
A marca evaporou a urina e obteve um resíduo escuro, que retido por vários meses. A essa areia adicionada e aqueceu -a, conseguindo eliminar gases e óleos. Finalmente, ele obteve um sólido branco que brilhava no escuro com uma cor verde, que ele chamou de "fogo frio".
O termo 'fósforo', coincidentemente vem da palavra grega "fosforos", que significa portador da luz.
Brand não publicou seus resultados experimentais e o vendeu para vários alquimistas, incluindo: Johann Kraft, Kunckel Lowenstern e Wilhelm Leibniz. Provavelmente, alguns deles relataram o trabalho da Brand à Academia de Ciências de Paris, divulgando assim suas investigações.
No entanto, a marca realmente não isolou o fósforo, mas o fosfato de sódio amoniacal [NH (NH4) Po4]. Em 1680, Robert Boyle melhorou o procedimento da marca, através do qual ele poderia obter uma forma almotrópica de fósforo (p4).
Nos ossos
Johan Gottlieb Gahn e Carl Wihelm Scheele estabeleceram em 1769 que um composto de fósforo, fosfato de cálcio, estava nos ossos. Os ossos infortados foram submetidos a um processo de digestão com ácidos fortes, como o ácido sulfúrico.
Em seguida, o produto da digestão foi aquecido em recipientes de aço com carvão e carvão, obtendo assim o fósforo branco por destilação em Retort. Os ossos eram a principal fonte que obteve fósforo até 1840, quando foram substituídos para esse fim pelo Guano.
No guano
Guano é uma mistura de pássaros de pássaros e produtos de decomposição deles. Foi usado como fonte de fósforo e fertilizantes no século 19.
- Desenvolvimento Industrial
Rochas de fosfato foram usadas em 1850 como fonte de fósforo. Isso, juntamente com a invenção do forno elétrico para calcinar as rochas de James Burges Readman (1888), fez de rochas fosfáticas a principal matéria -prima da produção e fertilizantes de fósforo.
Em 1819, foram estabelecidas fábricas de Cerrilhas, iniciando o desenvolvimento industrial de fósforo.
Propriedades físicas e químicas
Aparência
Dependendo da forma alotrópica, pode ser incolor, fechado branco, amarelo, escarlate, vermelho, violeta ou preto.
Peso atômico
30.973 u
Número atômico (Z)
quinze
Ponto de fusão
Fósforo branco: 44,15 ºC
Fósforo vermelho: ~ 590 ºC
Ponto de ebulição
Fósforo branco: 280,5 ºC
Densidade (temperatura ambiente)
Branco: 1.823 g/cm3
Vermelho: 2.2-2,34 g/cm3
Violet: 2,36 g/cm3
Preto: 2,69 g/cm3
Calor de fusão
Fósforo branco: 0,66 kJ/mol/mol
Calor de vaporização
Fósforo branco: 51,9 kJ/mol/mol
Capacidade calórica molar
Fósforo branco: 23.824 J/(mol.K)
Estados de oxidação
-3, -2, -1, +1, +2, +3, +4 e +5
Dependendo da eletronegatividade dos elementos com os quais o fósforo pode mostrar o estado de oxidação +3 ou -3. O fósforo, diferentemente do nitrogênio, tende a reagir de preferência com o estado de oxidação +5; É o caso do pentóxido de fósforo (P2QUALQUER5 ou p25+QUALQUER52+).
Pode atendê -lo: materiais solúveisEletro-negatividade
2,19 na escala Pauling
Energia de ionização
-Primeiro: 1.101 KJ/mol
-Segundo: 2.190,7 KJ/mol
-Terceiro: 2.914 KJ/mol
Condutividade térmica
Fósforo branco: 0,236 W/(M · K)
Fósforo preto: 12,1 com (M · k)
Ele mostra como o fósforo preto conduz quase seis vezes mais calor que o fósforo branco.
Ordem magnética
As correspondências brancas, vermelhas, violeta e pretas são diamagnéticas.
Isótopos
O fósforo tem 20 isótopos, sendo os principais: 31P, o único isótopo estável com uma abundância de 100%; 32P, isótopo β emissor- e com meia -vida de 14,28 dias; e 33P, um isótopo de emissor β- E com meia -vida de 25,3 dias.
Fosforescência
O fósforo branco é fosforescente e emite uma luz verde no escuro.
Alterações alotrópicas
O fósforo branco é instável e muda para temperaturas próximas a 250 ºC para uma forma polimérica conhecida como fósforo vermelho, que pode variar laranja a laranja roxa. É uma substância amorfa, mas pode se tornar cristalina; Não brilha no escuro ou queima no ar.
O fósforo branco a altas temperaturas e pressões, ou na presença de catalisadores, é transformado em uma forma polimérica que não seja o fósforo vermelho: fósforo preto. Esta é uma substância cristalina preta e inerte, semelhante à grafite, e isso tem a capacidade de conduzir eletricidade.
Solubilidade
O fósforo branco puro é insolúvel em água, embora possa ser solubilizado em sulfeto de carbono. Enquanto isso, as partidas vermelhas e pretas são insolúveis na água e são menos voláteis que o fósforo branco.
Reatividade
Fósforo queima espontaneamente no ar para formar o P2QUALQUER5, E isso, por sua vez, pode reagir com três moléculas de água para formar ácido ortofosfórico ou fosfórico (H3Po4).
Por ação da água quente origina fosfina (pH3) e oxácidos de fósforo.
O ácido fosfórico atua em rochas fosfatadas, causando fosfato de cálcio de di -hidrogênio ou superfosfato [CA [CA2Po4)2].
Você pode reagir com halogênios para formar os halogenetos PX3, representando x a f, cl, br ou i; o haluros com fórmula px5, Sendo x, cl ou br.
Além disso, o fósforo reage com metais e metalóides para causar fosfídeos, e o enxofre para formar vários sulfetos. Por outro lado, ele se liga ao oxigênio para originar os ésteres. Da mesma maneira, é combinado com carbono para formar os compostos orgânicos de fósforo.
Estrutura e configuração eletrônica
- Links e unidade tetraédrica
Os átomos de fósforo têm a seguinte configuração eletrônica:
[NE] 3s2 3p3
Portanto, cinco elétrons de Valência, como o nitrogênio e os outros elementos do grupo 15. Por ser um elemento não -metálico, seus átomos precisam formar ligações covalentes até que o Octeto de Valencia seja concluído. O nitrogênio o alcança quando estabelecido como moléculas de datômica n2, Com um link triplo, n tal.
O mesmo vale para o fósforo: dois de seus átomos P estão ligados a uma ligação tripla para formar a molécula P2, P≡P; Isto é, o Alotrópio de Dipósforo. No entanto, o fósforo possui uma massa atômica maior que o nitrogênio e seus orbitais 3p, mais difusos que o 2P de nitrogênio, se sobrepõem a menos eficiência; Portanto, o P2 Só existe no estado gasoso.
Em vez disso, à temperatura ambiente, os átomos P preferem organizar covalentemente de outra maneira: em uma molécula tetraédrica p4:
 Unidades moleculares P4 em cristais de fósforo branco. Fonte: Benjah-BMM27 via Wikipedia.
Unidades moleculares P4 em cristais de fósforo branco. Fonte: Benjah-BMM27 via Wikipedia. Observe que, na imagem superior, todos os átomos P têm três links simples em vez de um link triplo. Assim, fósforo em P4 Complete seu Octeto de Valencia. No entanto, em P4 Há tensão nos links P-P, já que seus ângulos estão indo para o olho nu de ser 109,5 °.
- Aastoopes
Fósforo branco
A mesma imagem das unidades P4 E sua instabilidade explica por que o fósforo branco é o mais instável Apotrópico deste elemento.
As unidades p4 Eles são ordenados no espaço para definir um cristal BCC (fase α) em condições normais. Quando a temperatura desce para -77,95 ºC, o vidro BCC é transformado em um HCP (presumivelmente), mais denso (fase β). Isto é, as unidades P4 Eles são ordenados em duas camadas alternativas, A e B, para estabelecer uma sequência de ABAB ..
Fósforo vermelho
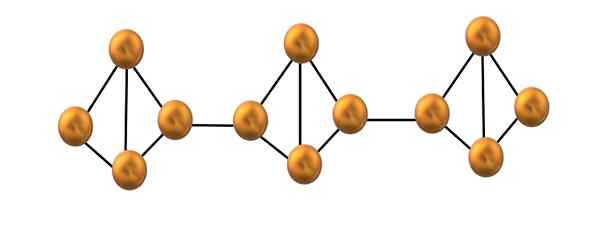 Estrutura da cadeia de fósforo vermelho. Fonte: Gabriel Bolívar.
Estrutura da cadeia de fósforo vermelho. Fonte: Gabriel Bolívar. Na imagem superior, apenas um pequeno segmento da estrutura do fósforo vermelho é mostrado. Sendo as três unidades alinhadas "simetricamente", pode -se dizer que é uma estrutura cristalina, obtida pelo aquecimento deste fósforo acima de 250 ºC.
Fósforo vermelho, no entanto, na maioria das vezes consiste em um amorfo sólido, então sua estrutura é bagunçada. Então, as cadeias poliméricas de P4 Eles teriam sem padrão aparente, um acima e outros abaixo do mesmo plano arbitrariamente.
Observe que esta é a principal diferença estrutural entre fósforo branco e vermelho: no primeiro4 Eles são individuais e na segunda formação de correntes. Isso é possível porque um dos links P-P é quebrado dentro do tetraedro para poder vincular-se ao tetraedro vizinho. Assim, a tensão anular e o fósforo vermelho são reduzidos mais estabilidade.
Pode atendê -lo: zinco: história, propriedades, estrutura, riscos, usosQuando há uma mistura de ambos os dois, ela é oferecida à vista como um fósforo amarelo; Uma mistura de cadeias de fósforo tetraedros e amorfo. De fato, fósforo branco.
Fósforo violeta ou hittorf
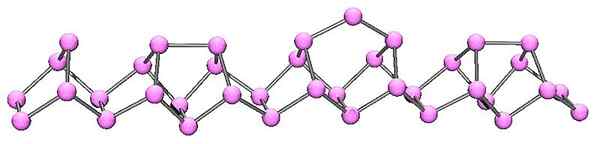 Estrutura molecular do fósforo violeta. Fonte: Cádmio na Wikipedia Inglês [Domínio Público]
Estrutura molecular do fósforo violeta. Fonte: Cádmio na Wikipedia Inglês [Domínio Público] Violet Fosforus é a evolução final do fósforo vermelho. Como pode ser visto na imagem superior, continua a consistir em uma cadeia polimérica; Mas agora as estruturas são mais complexas. Parece que a unidade estrutural não é mais o P4 mas p2, dispostos de tal maneira que eles formam anéis pentagonais irregulares.
Apesar da aparência assimétrica da estrutura, essas cadeias poliméricas conseguem pedir bem o suficiente e periodicamente, para que a fósforo violeta.
Fósforo preto
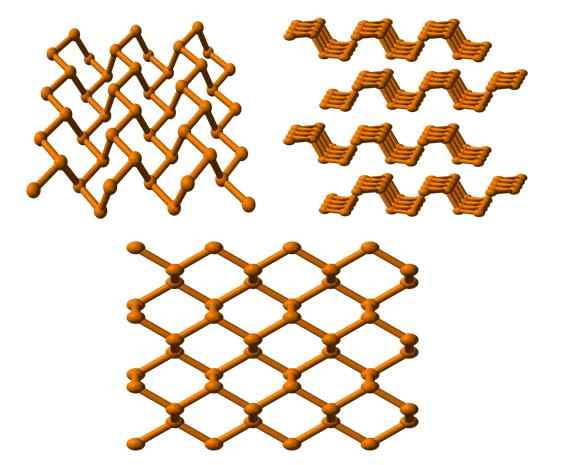 Estrutura de fósforo preto visto de vários ângulos. Fonte: Benjah-BMM27 [Domínio Público].
Estrutura de fósforo preto visto de vários ângulos. Fonte: Benjah-BMM27 [Domínio Público]. E finalmente temos o fósforo mais estável e a cor preta. Prepara o fósforo branco sob uma pressão de 12.000 atm.
Na imagem superior (abaixo), pode -se observar que sua estrutura, de um plano mais alto, tem uma certa semelhança com a da grafite; É uma rede íngreme de anéis hexagonais (embora eles pareçam quadrados).
No canto superior esquerdo da imagem, você pode apreciar melhor os recém -comentados. Ambientes moleculares de átomos de P são pirâmide trigonal. Observe que a visão da estrutura lateralmente (canto superior direito) é organizado em camadas que se encaixam no outro.
A estrutura do fósforo negro é bastante simétrico e ordenado, o que concorda com sua capacidade de se estabelecer como cristais ortorrômbicos. O empilhamento de suas camadas de polímero faz com que os átomos de P não estejam disponíveis para muitas reações químicas; E é por isso que é consideravelmente estável e pouco reativo.
Embora não seja necessário mencioná -lo, as forças de dispersão de Londres e as massas molares desses sólidos fosfóricos são aqueles que governam algumas de suas propriedades físicas; enquanto suas estruturas e ligações p-p definem as propriedades químicas e outras.
Onde está e obtenha
Apatita e fosforita
É o doze elemento da crosta terrestre e representa 0,1% dele em peso. Existem cerca de 550 minerais que contêm fósforo, sendo a Apatita o mineral mais importante para obter fósforo.
Apatita é um mineral de fósforo e cálcio que pode conter quantidades variáveis de fluoreto, cloreto e hidróxido, cuja fórmula é a seguinte: [Ca10(Po4)6(F, cl ou oh)2)]. Além da apatita, existem outros minerais de fósforo de importância comercial; É o caso de Wavelita e Vivianita.
Fosfato ou rocha fosforita é a principal fonte de fósforo. É uma rocha sedimentar não detítica que possui um conteúdo de fósforo de 15 a 20%. O fósforo geralmente está presente como CA10(Po4)6F2 (fluoroapatita). Também está presente como hidroxiapatita, embora em menor grau.
Além disso, a fluoroapatita pode ser encontrada parte das rochas ígneas e metamórficas, bem como calcários e xisto.
Redução eletrotérmica de fluoroapatita
Rochas de fosfato selecionadas são transferidas para a estação de tratamento para processamento. Inicialmente, eles são esmagados para obter fragmentos de rocha que são então moídos em moinhos de bolas a 70 revoluções por minuto.
Então, o produto da moagem dos fragmentos de rocha está sendo peneirado para poder falhar. Essas frações são escolhidas com um teor de fósforo de 34%, como o pentóxido de fósforo (p2QUALQUER5).
Fósforo branco (P4) É obtido industrialmente pela redução eletrotérmica de fluoroapatita com carbono a uma temperatura de 1.500 ºC na presença de óxido de silício:
2CA3(Po4)2(s) + 6sio2(s) + 10 c (s) => p4(g) + casio3(L) + CO (G)
O p4 Em um estado gasoso, após o condensação, é coletado e armazenado como um sólido branco submerso na água para evitar reagir com o ar externo.
Ligas
Coppery
A cobertura de fósforo é fabricada com diferentes porcentagens de cobre e fósforo: Cu 94 % - P 6 %; Cu 92% - P 8%; Cu 85% - p 15%, etc. A liga é usada como desoxidante, agente hidratante da indústria de cobre e também como nucleant na indústria de alumínio.
Broncine
São ligas de cobre, fósforo e estanho contendo 0,5 a 11% de fósforo e 0,01 - 0,35%. A lata aumenta a resistência à corrosão, enquanto o fósforo.
É usado na elaboração de nascentes, parafusos e, em geral, em artigos que requerem fadiga, desgaste e corrosão química. Seu uso em hélices de vasos é recomendado.
Pode atendê -lo: cádmio (CD): história, propriedades, estrutura, usosNictelladas
A liga mais conhecida é o beliscãovinte, Usando o níquel fosforado em fortes ligas de solda, para melhorar sua resistência à erosão química, oxidação e altas temperaturas.
A liga é usada em componentes de motores a gás e reação, galvanoplastia e na produção de eletrodos de soldagem.
Riscos
O fósforo branco produz queimaduras graves e é um veneno poderoso que pode ser mortal na dose de 50 mg. O fósforo inibe a oxidação celular, interferindo no gerenciamento celular de oxigênio, o que pode levar à degeneração de gordura e à morte da célula.
O envenenamento agudo do fósforo produz nos primeiros quatro dias da dor abdominal da ingestão, ardor, respiração com o cheiro de alho, vômito fosforescente, suor, cólicas musculares e até um estado de choque.
Posteriormente, uma icterícia, petechiae, hemorragia, afetação do miocárdio com arritmias, alteração do sistema nervoso central e morte no décimo dia de ingestão se manifestam.
A manifestação mais óbvia do envenenamento crônico de fósforo é dano à estrutura óssea da mandíbula.
Um aumento na concentração plasmática de fósforo (hiperfospatia) é geralmente apresentado em pacientes com insuficiência renal. Isso causa um depósito anormal de fosfatos em tecidos moles, o que pode levar a disfunção vascular e doença cardiovascular.
Formulários
O fósforo é um elemento essencial para plantas e animais. É um dos três principais nutrientes das plantas, sendo necessário para seus requisitos de crescimento e energia. Além disso, faz parte de ácidos nucleicos, fosfolipídios, produtos intermediários de processos metabólicos, etc.
Nos vertebrados, o fósforo está presente em ossos e dentes na forma de hidroxilapatita.
- Fósforo elementar
 Uma caixa de fósforos ou "fósforo". Fonte: pxhere.
Uma caixa de fósforos ou "fósforo". Fonte: pxhere. Com o fósforo, é fabricado um esmalte químico que é usado para iluminar avisos colocados em alumínio e suas ligas; bem como em cobre e bronze fosforado.
Também é usado para fazer bombas incendiárias, granadas, bombas de fumaça e balas traçadoras. O fósforo vermelho é usado na elaboração de correspondências ou partidas de segurança.
O fósforo branco é usado para a elaboração de organofosfato. Além disso, é usado na produção de ácido fosfórico.
Uma grande quantidade de fósforo produzida é incinerada para a produção de tetraxido de fósforo (p4QUALQUER10), obtido como um pó ou um sólido.
- Compostos
Fosfina
É a matéria -prima para a elaboração de vários compostos de fósforo. Ele atua como um agente de doping para componentes eletrônicos.
Ácido fosfórico
É usado na elaboração de refrigerantes devido ao gosto característico que os confere. Agir em rochas fosfato para formar fosfato de cálcio di -hidrogênico2Po4)2], também conhecido como superfosfato, que é usado como fertilizante.
O ácido fosfórico é um condicionador de elementos do esmalte dental para facilitar a adesão dos materiais de sua restauração. Também é usado, misturado com óleo, uréia, quebra, betume e areia, para formar o asfalto; Material usado no reparo de canais de comunicação terrestre.
Organofosforado
Os compostos organofosforos têm inúmeras aplicações; como: retardadores de chama, pesticidas, agentes de extração, agentes de ação nervosa e tratamento de água.
Di -hidrato di -hidrato fosfato de cálcio
É usado como fertilizante, fermento em pó, aditivo alimentar de animais e na elaboração de pastas dentárias.
Pentóxido de fósforo
É usado na análise química como agente desidratante e na síntese orgânica como agente do condensador. O composto é alocado principalmente para a produção de ácido ortofosfórico.
Tripolifosfato de sódio
É usado em detergentes e como amaciador de água, o que melhora a ação dos detergentes e ajuda a evitar a corrosão dos tubos.
Fosfato trissódico
É usado como agente de limpeza e amaciador de água.
Fosfatos de sódio
Fosfato de sódio dibásico (NA2HPO4) e fosfato de sódio monobásico (NAH2Po4) são os componentes de um sistema de absorvedor de choque de pH, que atua nos seres vivos; Entre eles seres humanos.
Referências
- Reid Danielle. (2019). Alotrópio de fósforo: formas, usos e exemplo. Estudar. Recuperado de: estudo.com
- Prof. Robert J. Lancashire. (2014). Palestra 5c. Estrutura dos elementos, continue p, s e eu. Recuperado de: química.Uwimona.Edu.JM
- Byju's. (2019). Phosforus vermelho. Recuperado de: byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang, et al. (2019). Propriedades estruturais e ópticas eletrônicas de fósforo azul multicamada: um estudo de primeiro princípio. Jornal de Nanomateriais, vol. 2019, artigo ID 4020762, 8 páginas. doi.org/10.1155/2019/4020762
- Dr. Dough Stewar. (2019). Fatos do elemento de fósforo. Chemicool. Recuperado de: Chemicool.com
- Wikipedia. (2019). Fósforo. Recuperado de: em.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (3 de julho de 2019). Fatos de fósforo (número atômico 15 ou símbolo do elemento p). Recuperado de: pensamento.com
- Instituto de Linus Pauling. (2019). Fósforo. Recuperado de: LPI.Oregonstate.Edu
- Bernardo Fajardo p. & Héctor Lozano V. (s.F.). Processamento nacional de rochas fosfóricas para produção de superfosfato. [PDF]. Recuperado de: bdigital.um i.Edu.co
- Os editores da Enyclopaedia Britannica. (16 de novembro de 2018). Elemento químico de fósforo. Encyclopædia britannica. Recuperado de: Britannica.com
- READE International Corp. (2018). Liga de fósforo de cobre (copo). Recuperado de: Reade.com
- Affilips KBM. (27 de dezembro de 2018). Liga mestre de fósforo de níquel (NIP). Azom. Recuperado de: azom.com
- Lentech b.V. (2019). Tabela de período: fósforo. Recuperado de: lentech.com
- Abhijit Naik. (21 de fevereiro de 2018). Uso de fósforo. Recuperado de: sciencestruck.com
- « Explicação de pressão manométrica, fórmulas, equações, exemplos
- Origem da cultura de Tríncheras, características, religião, cultura »

