Estrutura de fosfuro de alumínio (AIP), propriedades, usos, riscos

- 4480
- 365
- Ralph Kohler
Ele fosfido de alumínio É um composto inorgânico formado por um átomo de alumínio (Al) e um átomo de fósforo (P). Sua fórmula química o alp. É um sólido cinza escuro ou, se for muito puro, amarelo. É um composto extremamente tóxico para os seres vivos.
O fosfuro de alumínio reage com umidade para formar fosfina ou fosfano pH3, que é um gás venenoso. Por esse motivo, o ALP não deve entrar em contato com a água. Reage fortemente com ácidos alcalinos e soluções.
 Fosfido de alumínio. Marcs [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Fonte: Wikimedia Commons.
Fosfido de alumínio. Marcs [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Fonte: Wikimedia Commons. Foi usado no passado para eliminar pragas como insetos e roedores em locais onde grãos de cereais e outros produtos agrícolas foram armazenados. No entanto, devido ao seu alto perigo, foi proibido na maioria dos países do mundo.
Atualmente, sua utilidade na área eletrônica é teoricamente investigada através de computadores que calculam a possibilidade de obter nanotubos ALP semicondutores, ou seja, tubos extremamente pequenos que podem transmitir eletricidade apenas sob certas condições.
O fosfuro de alumínio é um composto muito perigoso, deve ser manipulado com implementos de segurança, como luvas, lentes, equipamentos de respiração e roupas de proteção.
[TOC]
Estrutura
O fosfuro de alumínio alp é formado pela união de um átomo de alumínio no fósforo P Atom P. A ligação entre os dois é covalente e tripla, portanto é muito forte.
O alumínio no ALP tem um estado de oxidação de +3 e o fósforo tem uma valência de -3.
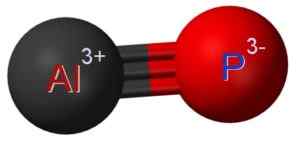 Estrutura de fosfuro de alumínio, onde você pode ver o link triplo entre átomos de alumínio (Al) e fósforo (P) (P). Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Estrutura de fosfuro de alumínio, onde você pode ver o link triplo entre átomos de alumínio (Al) e fósforo (P) (P). Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. Nomenclatura
- Fosfido de alumínio
Propriedades
Estado físico
Cinzento escuro e amarelo cristalino cinza escuro. Cristais cúbicos.
Peso molecular
57.9553 g/mol
Ponto de fusão
2550 ºC
Densidade
2,40 g/cm3 a 25 ° C
Solubilidade
Se decompõe na água.
Propriedades quimicas
Reage com umidade para dar fosfina ou fosfano pH3 que é um composto inflamável e venenoso. Fosfina ou fosfaan.
Pode atendê -lo: gadolinio: estrutura, propriedades, obtenção, usosA reação de fosfuro de alumínio com água é a seguinte:
Fosfuro de alumínio + água → hidróxido de alumínio + fosfina
Alp + 3 h2O → para (oh)3 + Ph3↑
Apresentações comerciais têm carbonato de alumínio para o2(Co3)3 Para impedir a auto -direção da fosfina que ocorre quando o ALP entra em contato com a umidade do ar.
ALP é estável quando está seco. Reage violentamente com ácidos alcalinos e soluções.
O fosfuro de alumínio alp não derrete, nem sublimal ou se decompõe termicamente a temperaturas tão altas quanto 1000 ° C. Mesmo nessa temperatura, sua pressão de vapor é muito baixa, ou seja, não evapora nessa temperatura.
Quando aquecido em sua decomposição emite óxidos tóxicos de fósforo. Em contato com metais, você pode emitir gases de hidrogênio inflamáveis H2.
Outras propriedades
Quando é puro, mostra uma coloração amarelada, quando é misturada com restos da reação de preparação, apresenta cor de cinza a preto.
Sua baixa volatilidade exclui que tem um cheiro, então o cheiro de alho que às vezes emite é devido ao pH da fosfina3 que é formado na presença de umidade.
Obtenção
O fosfuro de alumínio pode ser obtido aquecendo uma mistura de pó de metal de alumínio (Al) e o elemento de fósforo vermelho (P).
Devido à afinidade do fósforo (P) por oxigênio (ou2) e o de alumínio (Al) por oxigênio e nitrogênio (N2), A reação deve ser realizada em uma atmosfera livre desses gases, como a atmosfera de hidrogênio (H2) ou gás natural.
A reação começa a aquecer rapidamente uma área da mistura até que a reação comece, o que é exotérmico (o calor ocorre durante o mesmo). A partir desse momento, a reação prossegue rapidamente.
Alumínio + fósforo → fosfuro de alumínio
4 a + P4 → 4 alp
Formulários
Na eliminação de pragas (uso descontinuado)
O fosfuro de alumínio foi usado no passado como inseticida e como exterminador de roedores. No entanto, embora tenha sido proibido por sua toxicidade, ainda é usado em algumas partes do mundo.
Pode atendê -lo: .Ácido esteárico (CH3 (CH2) 16cooh): estrutura, propriedades, usosÉ usado para fumigação em espaços fechados, onde são encontrados produtos alimentares processados ou não processados (como cereais), alimentos para produtos de animais e não alojados.
O objetivo é controlar insetos e roedores que atacam artigos armazenados, comestíveis ou não.
Permite controlar roedores e insetos em áreas não -domésticas, agrícolas ou não agrícolas, fumigando ao ar livre ou em suas tocas e ninhos para impedir que certas doenças transmitam.
 Ratos e ratos são pragas que atacam locais de armazenamento de cereais. Alguns anos atrás, eles foram lutados com fosfuro de alumínio. Autor: Andreas N. Fonte: Pixabay.
Ratos e ratos são pragas que atacam locais de armazenamento de cereais. Alguns anos atrás, eles foram lutados com fosfuro de alumínio. Autor: Andreas N. Fonte: Pixabay.  Os roedores foram controlados colocando fosfuro de alumínio em suas tocas. Autor: Photo-Rabe. Fonte: Pixabay.
Os roedores foram controlados colocando fosfuro de alumínio em suas tocas. Autor: Photo-Rabe. Fonte: Pixabay. Sua forma de uso consiste na exposição do ALP em ar ou umidade, à medida que a fosfina ou o pH fosfaan é liberada3 que gera danos a muitos órgãos de praga para eliminar.
 Os insetos também foram eliminados com fosfuro de alumínio alp. Autor: Michael Power. Fonte: UNSPASH.
Os insetos também foram eliminados com fosfuro de alumínio alp. Autor: Michael Power. Fonte: UNSPASH. Em outras aplicações
O fosfuro de alumínio alp é usado como fonte de fosfina ou fosfano pH3 e está sendo usado na pesquisa de semicondutores.
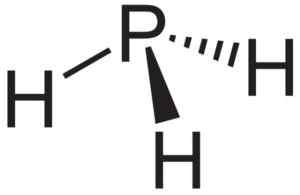 PH fosfaano ou fosfina3, composto que se forma quando o alumínio alp fosfuro entra em contato com a água. Neuroteker [domínio público]. Fonte: Wikimedia Commons.
PH fosfaano ou fosfina3, composto que se forma quando o alumínio alp fosfuro entra em contato com a água. Neuroteker [domínio público]. Fonte: Wikimedia Commons. Pesquisa teórica de nanotubos ALP
Estudos teóricos foram realizados sobre a formação de nanotubos de fosfuro de alumínio alp. Os nanotubos são cilindros muito pequenos e muito finos que podem ser visíveis apenas com um microscópio eletrônico.
Nanotubos alp com boro
Estudos teóricos realizados através de cálculos computacionais mostram que as impurezas que poderiam ser adicionadas aos nanotubos do ALP podem alterar as propriedades teóricas destes.
Por exemplo, estima -se que a adição de átomos de boro (b) a nanotubos ALP possa transformá -los em semicondutores do tipo-p. Um semicondutor é um material que se comporta como um condutor de eletricidade ou como isolante, dependendo do campo elétrico ao qual é submetido.
Pode atendê -lo: Estado do plasma: características, tipos e exemplosE um semicondutor de tipo-p É quando o material é adicionado impurezas, neste caso o ALP é o material de partida e os átomos de boro seriam impurezas. Semicondutores são úteis para aplicações eletrônicas.
Nanotubos ALP com estrutura alterada
Alguns cientistas realizaram cálculos para determinar o efeito da mudança da estrutura da rede cristalina dos nanotubos de ALP de hexagonal para octaédrico.
Eles descobriram que a manipulação da estrutura da rede cristalina poderia ser usada para ajustar a condutividade e a reatividade dos nanotubos ALP e projetá -los para que sejam úteis para aplicações eletrônicas e ópticas.
Riscos
O contato com fosfuro de alumínio pode irritar a pele, os olhos e as membranas mucosas. Se for ingerido ou inalado, é tóxico. Pode ser absorvido pela pele com efeitos tóxicos.
Se o ALP entrar em contato com a água reagir e a forma de fosfina ou pH fosfano3 o que é extremamente inflamável porque queima em contato com o ar. Portanto, pode explorar. Além disso, a fosfina causa a morte de humanos e animais.
Como um pesticida econômico é o fosfuro de alumínio, seu uso é uma causa comum de envenenamento das pessoas e implica uma alta taxa de mortalidade.
 O fosfuro de alumínio é extremamente perigoso. Autor: OpenClipart-Vectors. Fonte: Pixabay.
O fosfuro de alumínio é extremamente perigoso. Autor: OpenClipart-Vectors. Fonte: Pixabay. Reage com a umidade das membranas mucosas e com o ácido clorídrico HCl do estômago formando o fosfano pH muito tóxico3. Portanto, por inalação e ingestão, a fosfina é formada dentro do corpo, com efeitos fatais.
Sua ingestão causa hemorragia do trato gastrointestinal, colapso cardiovascular, distúrbios neuropsiquiátricos, insuficiência respiratória e renal em poucas horas.
O ALP é muito tóxico para todos os animais terrestres e aquáticos.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Alumínio de fosfido. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Sjögren, b. et al. (2007). Alumínio. Outros compostos de alumínio. No Manual sobre a Toxicologia dos Metais (terceira edição). Recuperado de cientedirect.com.
- Gupta, r.C. e Crissman, J.C. (2013). Avaliação de segurança, incluindo questões atuais e emergentes em patologia toxicológica. Risco humano. No Manual de Patologia Toxicológica de Haschek e Rousseaux (terceira edição). Recuperado de cientedirect.com.
- Branco, w.E. e Bushey, para.H. (1944). Phosfeto de alumínio - Preparação e composição. Jornal da American Chemical Society 1944, 66, 10, 1666-1672. Recuperado de bares.ACS.org.
- Mirzaei, Maryam e Mirzaei, Mahmoud. (2011). Um estudo teórico de nanotubos de fosfido de alumínio-due de boro-due. Química computacional e teórica 963 (2011) 294-297. Recuperado de cientedirect.com.
- Takahashi, l. E Takahashi, K. (2018). Ajustando a estrutura eletrônica de um nanotubo de fosfido de alumínio. ACS APPL. Nano Mater. 2018, 1, 501-504. Recuperado de bares.ACS.org.
- Gupta, p.K. (2016). Efeitos tóxicos de pesicidas (agroquímicos). Alumínio de fosfido. Em fundos de toxicologia. Recuperado de cientedirect.com.
- « Coordenadas retangulares Exemplos e exercícios resolvidos
- Grau de um polinômio como é determinado, exemplos e exercícios »

