Estrutura de fluoreto de lítio, propriedades, obtenção, usos

- 4616
- 314
- Melvin Mueller
Ele Fluoreto de lítio É um sólido inorgânico cuja fórmula química é LIF. É formado por íons li+ e f- que estão unidos através de um vínculo iônico. É encontrado em pequenas quantidades em vários minerais, especialmente silicatos como lepidolito, água do mar e em muitos poços minerais.
Ele teve amplo uso em dispositivos ópticos devido à sua transparência em uma ampla gama de comprimentos de onda, desde o espectro infravermelho (IR) até o UV ultravioleta, através do visível.
 Lepidolite, mineral que contém pequenas quantidades de fluoreto de vida. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Lepidolite, mineral que contém pequenas quantidades de fluoreto de vida. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. Também tem sido usado em dispositivos para detectar radiação perigosa em empregos nos quais as pessoas são expostas a eles por um curto período de tempo. Além disso, é usado como material para derreter alumínio ou fazer óculos ou óculos de vidro e fabricação.
Serve como material para cobrir os componentes das baterias de lítio e impedir a perda inicial de carregamento destes.
[TOC]
Estrutura
O fluoreto de lítio é um composto iônico, ou seja, formado pela união da liocação+ e o ânion f-. A força que os mantém juntos é eletrostática e é chamada de ligação iônica.
Quando o lítio é combinado, ele fornece um elétron ao fluoreto, ambos sendo mais estáveis do que o caminho inicial, como explicado abaixo.
O elemento de lítio tem a seguinte configuração eletrônica: [ele] 1s2 2s1 E ao dar a um elétron, a estrutura eletrônica é assim: [ele] 1s2 o que é muito mais estável.
O elemento flúor cuja configuração eletrônica é: [ne] 1s2 2s2 2 p5, Ao aceitar o elétron é a forma [ne] 1s2 2s2 2 p6, mais estável.
Nomenclatura
- Fluoreto de lítio
- Fluorolitio
Pode atendê -lo: óxidos não -metálicos- Monofluoreto de lítio
Propriedades
Estado físico
Sólido branco, que cristaliza em estrutura cúbica, como NaCl de cloreto de sódio.
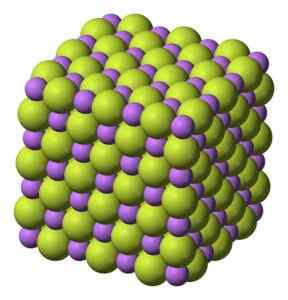 Estrutura cúbica de cristais de fluoreto de lítio de vida. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Estrutura cúbica de cristais de fluoreto de lítio de vida. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Peso molecular
26 g/mol
Ponto de fusão
848.2 ºC
Ponto de ebulição
1673 ºC, embora seja volatilizado em 1100-1200 ºC
Densidade
2.640 g/cm3
Índice de refração
1.3915
Solubilidade
Pouco solúvel em água: 0,27 g/100 g de água a 18 ºC; 0,134 g/100 g a 25 ºC. Solúvel em meio ácido. Insolúvel em álcool.
Outras propriedades
Seus vapores têm espécies dimiciadas (LIF)2 e trimérico (LIF)3. Com o ácido fluorérico da HF forma lítio lítio2; Com hidróxido de lítio, ele forma um sal de vida duplo.Lioh.
Obtenção e localização
O fluoreto de lítio de LIF pode ser obtido por reação entre o ácido fluorhorérico da IC e o hidróxido de lítio lioh ou carbonato de lítio de lítio2Co3.
No entanto, está presente em pequenas quantidades em certos minerais, como lepidolito e água do mar.
 O fluoreto de lítio é encontrado em pequenas quantidades na água do mar. Adeeb Atwan [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]. Fonte: Wikimedia Commons.
O fluoreto de lítio é encontrado em pequenas quantidades na água do mar. Adeeb Atwan [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]. Fonte: Wikimedia Commons. Formulários
Em aplicações ópticas
A LIF é usada na forma de cristais compactos em espectrofotômetros infravermelhos (IR) devido à excelente dispersão que eles têm no intervalo de comprimento de onda entre 4000 e 1600 cm-1.
Os cristais de LIF LIF são obtidos de soluções saturadas deste sal. Ele pode substituir os cristais de fluorita naturais em vários tipos de dispositivos ópticos.
Cristais grandes e puros são usados em sistemas ópticos para luz ultravioleta (UV), monocromadores visíveis e IR e raios-X (0,03-0,38 nm).
 Life Life Fluoruro Crystal, dentro de um copo. V1adis1av [domínio público]. Fonte: Wikimedia Commons.
Life Life Fluoruro Crystal, dentro de um copo. V1adis1av [domínio público]. Fonte: Wikimedia Commons. Também é usado como material de revestimento óptico para a região UV devido à sua ampla faixa óptica, maior que a de outros fluoretos de metal.
Pode servir a você: metais alcalinotherrososSua transparência no UV distante (90-200 nm) o torna ideal como um revestimento protetor em espelhos de alumínio (AL). Os espelhos LIF/AL têm uso em sistemas de telescópios ópticos para aplicações espaciais.
Esses revestimentos são alcançados pela deposição física de deposição de vapor e camada no nível atômico.
Em detectores de radiação ionizantes ou perigosos
O fluoreto de lítio tem sido amplamente utilizado em detectores termoluminescentes para fótons, nêutrons e radiação β (beta).
Detectores termoluminescentes mantêm a energia da radiação quando expostos a isso. Posteriormente, ao aquecê -los, liberam a energia armazenada em forma de luz.
Para esta aplicação, a LIF é geralmente datada com impurezas de magnésio (MG) e titânio (TI). Essas impurezas geram certos níveis de energia que atuam como orifícios onde os elétrons liberados por radiação estão presos. Quando o material aqueceu, esses elétrons retornam ao seu estado de energia original emitindo luz.
A intensidade da luz emitida depende diretamente da energia absorvida pelo material.
Os detectores termoluminescentes de LIF foram testados com sucesso para medir campos de radiação complexos, como os presentes no Large Hadron Collider, ou LHC (por seu acrônimo para inglês Large Hadron Collider), localizado na Organização Europeia de Pesquisa Nuclear, conhecida como CERN (por seu acrônimo de francês Conseil Européen derramar o Recherche Nucleaire).
A radiação nas experiências realizadas nesse centro de pesquisa apresenta hadrones, nêutrons e elétrons/pósitrons, entre outros tipos de partículas subatômicas, que podem ser detectadas com a vida.
Como material para prelocar o cátodo da bateria de lítio
A LIF foi testada com sucesso na forma de nanocompósitos com cobalto (CO) e ferro (fé) como materiais para a pré -conclusão (tradução do inglês Prelitioation) do material do cátodo da bateria de lítio.
Pode atendê -lo: éter etílicoDurante o primeiro ciclo de carga ou estágio de formação de uma bateria de íons de lítio, o eletrólito orgânico é dividido para formar uma fase sólida na superfície do ânodo.
Este processo consome lítio do cátodo e reduz a energia entre 5 a 20% da capacidade total da bateria de íons de lítio.
Por esse motivo, foi investigada a pré -crítica eletroquímica do cátodo, que gera uma extração eletroquímica do lítio da nanocomposição, que atua como um doador de lítio, evitando assim o consumo de lítio do cátodo.
Os nanocompósitos LIF/CO e LIF/Fe têm uma alta capacidade de doar lítio para o cátodo, sendo fácil de sintetizar, estável em condições de processamento ambiental e de bateria.
 Bateria de íons de lítio. Autor: Sr.ちゅら さん. Lithium_battery * Dia da fotografia, agosto de 2005 * Pessoa da fotografia Aney. Fonte: Wikimedia Commons.
Bateria de íons de lítio. Autor: Sr.ちゅら さん. Lithium_battery * Dia da fotografia, agosto de 2005 * Pessoa da fotografia Aney. Fonte: Wikimedia Commons. Em vários usos
O fluoreto de lítio é usado como medidor de solda, especialmente alumínio, e em revestimentos de haste de solda. Também é usado em células de redução de alumínio.
É amplamente utilizado na fabricação de vidro (como os das lentes) em que o coeficiente de expansão diminui. Também é usado na fabricação de cerâmica. Além.
O LIF é um componente de combustível para foguetes e combustíveis para certos tipos de reatores.
LIF também é usado em diodos emissores de luz ou componentes fotovoltaicos, para a injeção de elétrons em camadas internas.
Referências
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- OU.S. Biblioteca Nacional de Medicina. (2019). Fluoreto lítio. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov.
- Obryk, b. et al. (2008). A resposta de diferentes tipos de detectores de fluoreto de lítio a campos de radiação mista de alta energia. Medidas de radiação 43 (2008) 1144-1148. Recuperado de cientedirect.com.
- Sol, e. et al. (2016). Em síntese química local do nanocompósito de fluoreto de lítio/metal para prelitiação de alta capacidade dos catodos. Nano Letters 2016, 16, 2, 1497-1501. Recuperado de bares.ACS.org.
- Hennessy, J. e Nikzad, S. (2018). Deposição da camada atômica de revestimentos ópticos de fluoreto de lítio para o ultravioleta. Inorganics 2018, 6, 46. MDPI se recuperou.com.
- « 10 Experiências científicas para secundário físico, química, biologia
- Estrutura do ácido metilmalônico, propriedades, síntese, usa »

