Helmholtz Livre Energy Units, como é calculado, exercícios resolvidos

- 2314
- 445
- Tim Mann
O Helmholtz Energia livre É um potencial termodinâmico que mede o trabalho útil de um sistema fechado em condições constantes de temperatura e volume. A energia livre de Helmholtz é denotada como F E é definido como a diferença da energia interna OU menos o produto de temperatura T Para entropia S:
F = u - t⋅s
Como é energia, é medido em Joules no Sistema Internacional (SI), embora outras unidades apropriadas também possam ser ergios (CGS), calorias ou volts de elétrons (EV).
 figura 1. Definição da energia de Helmholtz. Fonte: Pixabay.
figura 1. Definição da energia de Helmholtz. Fonte: Pixabay. A variação negativa da energia de Helmholtz durante um processo é equiparada ao trabalho máximo que o sistema pode executar em um processo isocórico, isto é, a um volume constante. Quando o volume não é constante, parte deste trabalho pode ser feita no meio ambiente.
Nesse caso, nos referimos ao trabalho em que o volume não varia, como o trabalho elétrico: dw = φdq, com φ como potencial elétrico e q como carga elétrica.
Se a temperatura também for constante, a energia de Helmholtz é minimizada quando o saldo é alcançado. Por tudo isso, a energia de Helmholtz é particularmente útil em processos de volume constante. Nesse caso, você tem:
- Para um processo espontâneo: ΔF < 0
- Quando o sistema está em equilíbrio: ΔF = 0
- Em um processo não espontâneo: ΔF> 0.
[TOC]
Como é calculado a energia livre de Helmholtz?
Conforme declarado no início, a energia de Helmholtz é definida como "a energia ou sistema interno, exceto o produto do sistema absoluto de temperatura, pela entropia s do sistema":
F = u - t⋅s
É uma função da temperatura t e volume V. As etapas para visualizar isso são as seguintes:
Pode atendê -lo: elétrons internos- A partir da primeira lei da termodinâmica, a energia interna ou está relacionada à entropia s do sistema e seu volume V para processos reversíveis através do seguinte relacionamento diferencial:
DU = DQ - DW = TDS - PDV
Isso segue essa energia interna ou é uma função das variáveis S e V, portanto:
U = u (s, v)
- Agora a definição de F E é derivado:
df = du - d (ts) = du - tds - sdt
- Substituindo lá a expressão diferencial obtida para DU na primeira etapa, permanece:
Df = TDS - PDV - TDS - SDT = -SDT - PDV
- Finalmente, conclui -se que F é uma função da temperatura t e volume V e pode ser expressa como:
F = f (t, v)
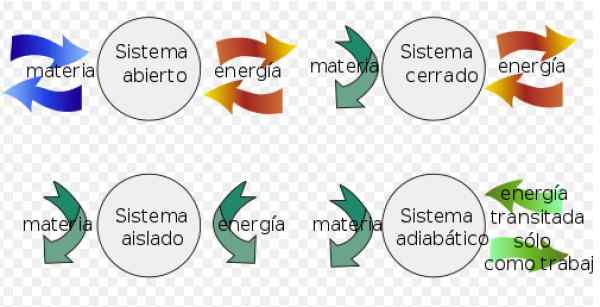 Figura 2. Hermann von Helmholtz (1821-1894), físico e médico alemão, reconhecido por suas contribuições ao eletromagnetismo e termodinâmica, entre outras áreas da ciência. Fonte: Wikimedia Commons.
Figura 2. Hermann von Helmholtz (1821-1894), físico e médico alemão, reconhecido por suas contribuições ao eletromagnetismo e termodinâmica, entre outras áreas da ciência. Fonte: Wikimedia Commons. Processos espontâneos
A energia de Helmholtz pode ser aplicada como um critério geral de espontaneidade em sistemas isolados, mas antes que alguns conceitos devem ser especificados:
- A sistema fechado Pode trocar energia com o meio ambiente, mas não pode trocar matéria.
- Em vez disso, um sistema isolado não troca matéria ou energia com o meio ambiente.
- Finalmente a sistema aberto trocar matéria e energia com o meio ambiente.
 Figura 3. Sistemas termodinâmicos. Fonte: Wikimedia Commons. Fjgar (bis) [CC BY-SA (https: // criativeCommons.Org/licenças/BY-SA/4.0)].
Figura 3. Sistemas termodinâmicos. Fonte: Wikimedia Commons. Fjgar (bis) [CC BY-SA (https: // criativeCommons.Org/licenças/BY-SA/4.0)]. Em processos reversíveis, a variação na energia interna é calculada da seguinte forma:
DU = TDS - PDV
Agora suponha que um processo de volume constante (isocórico), no qual o segundo termo da expressão anterior tem uma contribuição nula. Também deve ser lembrado que de acordo com o Desigualdade de Clausius:
DS ≥ DQ/T
Essa desigualdade se aplica a um sistema termodinâmico isolado.
Para que, para um processo (reversível ou não), no qual o volume é mantido constante é cumprido:
Pode servir você: ácido fosfórico (H3po4)T ds ≥ du (Em volume fixo)
Levando em consideração que:
df = du - t ds
Teremos que em um processo isocórico a temperatura constante é cumprida que: Df ≤ 0, Conforme indicado no começo.
Para que a energia de Helmholtz F seja uma quantidade decrescente em um processo espontâneo, enquanto é um sistema isolado. F atinge seu valor mínimo e estável quando o equilíbrio reversível foi atingido.
Exercícios resolvidos
Exercício 1
Calcule a variação da energia livre de Helmholtz F para 2 moles de gás ideal a uma temperatura de 300k durante uma expansão isotérmica que leva ao sistema de um volume inicial de 20 litros a um volume final de 40 litros.
Solução
Começando da definição de f:
F = u - t s
Em seguida, uma variação finita de F, chamada ΔF, será:
Δf = ΔU - T ΔS
Como a declaração afirma que a temperatura é constante: Δt = 0. No entanto, em gases ideais, a energia interna depende apenas de sua temperatura absoluta, mas como é um processo isotérmico, então ΔU = 0 e Δf = - t Δs. Para gases ideais, a variação de entropia de um processo isotérmico é escrita assim:
ΔS = n.R.ln (v2/V1)
Aplicando esta expressão:
ΔS = 2 moles x 8.314 j/(k mol) x ln (40l/20l) = 11,53 j/k
Finalmente, a mudança na energia de Helmholtz é:
Δf = - t ΔS = - 300k x 11,53 j/k = -3457,70 j.
Exercício 2
Dentro de um cilindro, há um pistão que o divide em duas seções e em cada lado do pistão, existem n toupeiras de um gás monoatômico ideal, como mostrado na figura abaixo.
As paredes do cilindro são boas condutores de calor (diatérmico) e estão em contato com um reservatório de temperatura Tqualquer.
O volume inicial de cada uma das seções do cilindro é V1i e V2i, enquanto seus volumes finais são V1f e V2f Após um deslocamento quase. O pistão se move por meio de um punir que atravessa hermeticamente as tapas de dois cilindros.
Pode servir a você: Tecnecio (TC): estrutura, propriedades, usos, obtençãoÉ solicitado a encontrar:
a) A mudança na energia interna do gás e o trabalho realizado pelo sistema e
b) Variação de energia de Helmholtz.
Solução para
À medida que o pistão se move quase, a força externa aplicada ao êmbolo deve equilibrar a força devido à diferença de pressão nas duas seções do cilindro.
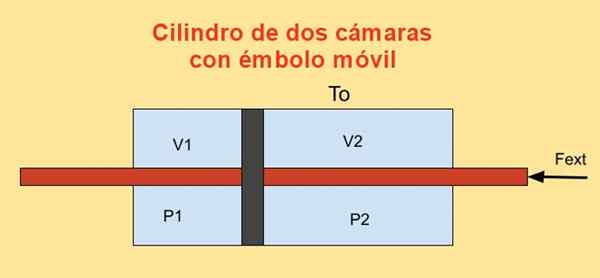 Figura 4. Variação da energia livre f em um cilindro com duas câmeras. Fonte: f. Zapata.
Figura 4. Variação da energia livre f em um cilindro com duas câmeras. Fonte: f. Zapata. O trabalho Dw Feito por força externa Fext Durante um deslocamento infinitesimal Dx é:
Dw = - fext Dx = (P1 - P2) A DX = P1 Dv1 + P2 Dv2
Onde o relacionamento foi usado Dv1 = - DV2 = Um dx, ser para A área do pistão. Por outro lado, a variação da energia de Helmholtz é:
Df = -sdt - pdv
Como durante o processo a temperatura não muda, então dt = 0 e Df = - PDV. Aplicando essa expressão a cada seção do cilindro que você tem:
dw = p1 Dv1 + P2 Dv2 = - df1 - Df2
Ser F1 e F2 As energias de Helmholtz em cada uma das câmeras.
O trabalho finito de W pode ser calculado a partir da variação finita da energia de Helmholtz de cada câmera:
W = -ΔF1 - ΔF2
Solução b
Para encontrar a mudança de energia de Helmholtz, a definição é usada: F = u - t s. Como em cada câmera, você tem um gás monoatômico ideal a temperatura constante Tqualquer, A energia interna não muda (ΔU = 0), de modo que: ΔF = - Tqualquer ΔS. Além do mais:
ΔS = nr ln (VF/Serra)
Isso substituindo -o finalmente permite o trabalho realizado é:
W = -tqualquer Nr ln (v1f /V1i) -To nr ln (v2f /V2i) = -ΔF1 -ΔF2
W = - para nr ln [(v1f ⋅ v1i)/(V2f .V2i)] = - ΔFtotal
Ser ΔFtotal A variação total da energia de Helmholtz.
Referências
- Castaños e. Exercícios de energia livre. Recuperado de: Lidiaconlachimica.WordPress.com
- Librettexts. Helmholtz Energy. Recuperado de: química.Librettexts.org
- Librettexts. O que são energia livre. Recuperado de: química.Librettexts.org
- Wikipedia. Helmholtz Energy. Recuperado de: é.Wikipedia.com
- Wikipedia. Helmholtz Energia livre. Recuperado de: em.Wikipedia.com

