Conceito de eletrólito forte, características, exemplos

- 5000
- 1591
- Terrence King IV
A Eletrólito forte É tudo o que a substância dissolvida na água ou em um solvente específico é completamente dissociado em íons. Portanto, não deve haver uma solução como moléculas neutras, ou como sólidos insolúveis. Um eletrólito forte pode ser um sal, um ácido ou uma base, desde que eles se dissocem ou completamente.
O exemplo mais representativo de um eletrólito é o sal comum, cloreto de sódio, NaCl. Em solução aquosa, os cristais de NaCl se dissociam na íntegra para produzir íons Na+ e cl-, que acabam circundando moléculas de água. Dizem então que um sal se comporta como um eletrólito forte quando sua solubilidade é muito alta na água.
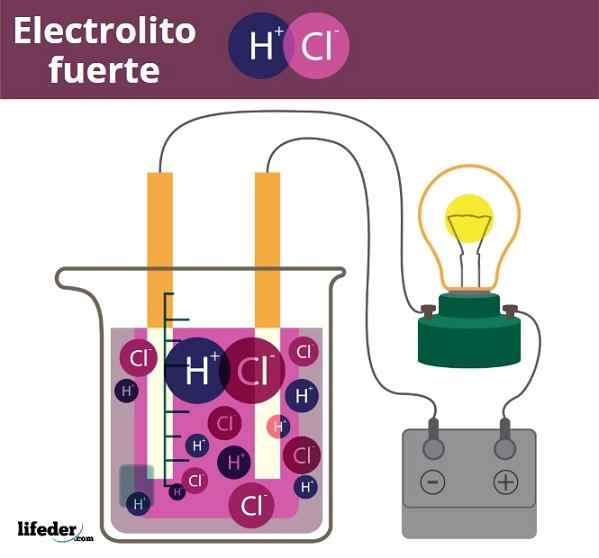 Exemplo de eletrolito de furo. HCl, ácido clorídrico, libere os íons H3O+ e cl-
Exemplo de eletrolito de furo. HCl, ácido clorídrico, libere os íons H3O+ e cl- Um pouco semelhante é o caso de ácidos e bases. Quando estes são fortes, suas soluções na água produzem a quantidade máxima possível de íons h3QUALQUER+ ou oh-, Portanto, as mudanças de pH são abruptas. Exemplos de ácidos fortes e bases são ácido nítrico, HNO3, e hidróxido de potássio, koh, respectivamente.
É importante saber como identificar eletrólitos fortes ao preparar soluções muito iônicas, ou ácido muito forte ou meios básicos.
[TOC]
Características de eletrólitos fortes
Solubilidade
Os eletrólitos fortes são caracterizados por serem substâncias de água extremamente solúveis. Seja sólido ou gases, ao entrar em contato com a água, não deve ser atrasado demais para se dissolver completamente. Se um sal, por exemplo, é pouco solúvel em água, pode ser descartado como um eletrólito forte.
Condutividade iônica
Eletrólitos fortes não são apenas muito solúveis em água, mas também geram um grande número de íons. Graças às cargas elétricas desses íons, os elétrons podem viajar confortavelmente nas soluções. Isso se reflete em um aumento na condutividade iônica em relação à água pura. É por isso que as soluções iônicas lideram muito bem a eletricidade.
Pode atendê -lo: cloro: história, propriedades, estrutura, riscos, usosNeutralidade salina
Muitos eletrólitos fortes salinos, ao se dissolver na água, não produzem nenhuma mudança de pH. Isso significa que as soluções desses sais não são ácidas ou básicas, mas neutras, com um pH próximo a 7.
No entanto, pode haver sais ácidos ou básicos que são facilmente dissolvidos na água e também geram íons completos. Por exemplo, carbonato de sódio2Co3, dissolve -se para gerar íons Na+ e companhia32-, Mas o pH da solução é básico.
Exemplos de eletrólitos fortes
 O cloreto de sódio é o exemplo mais representativo de um eletrólito forte. Fonte: Cristian V. /CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)
O cloreto de sódio é o exemplo mais representativo de um eletrólito forte. Fonte: Cristian V. /CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0) Os eletrólitos fortes, sendo tantos, são divididos em três classificações: ácidos fortes, bases fortes e sais solúveis produtos de neutralizações entre os dois primeiros.
Ácidos fortes
Ácidos fortes ao se dissolver na água, sem nenhum problema, devem produzir a quantidade máxima possível de H3QUALQUER+, Portanto, o ácido deve ser completamente íon; isto é, ele não deve existir como uma molécula neutra com prótons ácidos sem liberar.
Exemplos desses ácidos são:
-HCl, ácido clorídrico, libera íons H3QUALQUER+ e cl-
-HF, ácido fluorérico, libera íons H3QUALQUER+ e f-
-Hno3, Ácido nítrico, libere as pontas H3QUALQUER+ e não3-
-HCLO4, ácido perclórico, libera íons h3QUALQUER+ e clo4-
-Hio4, ácido periúúticos, libera íons h3QUALQUER+ e io4-
-H2SW4, ácido sulfúrico, libere as pontilhas H3QUALQUER+ Eu sou42-
A razão pela qual o íon hidrium, h3QUALQUER+, Está sempre presente (de uma maneira ou de outra), é porque o hidrogênio que eles doam é recebido por uma molécula de água:
HCl + H2O → h3QUALQUER+ + Cl-
A reação é direta e irreversível. Isso é uma característica de um ácido forte, que por sua vez é um eletrólito forte por causa de sua ionização completa na água.
Pode servir a você: hidrocarbonetos alifáticos: propriedades, nomenclatura, reações, tiposBases fortes
Bases fortes, dissolvendo -se em água sem nenhum problema, devem liberar íons oh- A partir dos mesmos cristais, ou irreversivelmente irrestracia, uma molécula de água para gerá -los.
Muitas bases fortes consistem em sólidos de íons e não -moleculares. Alguns exemplos dessas bases que se comportam como eletrólitos fortes são:
-Lioh, hidróxido de lítio, libera íons oh- e li+
-Naoh, hidróxido de sódio, libera íons OH- e na+
-Rboh, hidróxido de rubidio, libera íons oh- e RB+
-CA (OH)2, hidróxido de cálcio, liberação de íons OH- e ca2+
-SR (OH)2, Hidróxido de estrôncio, liberação de íons OH- e Sr2+
-Ba (oh)2, hidróxido de bário, libere íons oh- e ba2+
-Nah, hidreto de sódio, libera íons OH- e gás hidrogênio, h2
-NANH2, sódio amiduro, libere íons oh- e gás de amônia, NH3
Você sai
Hallobasi eletrólitos fortes ao se dissolver na água deve ser completamente íon. Muitos deles não produzem mudanças de pH. Isso ocorre porque seus íons são muito estáveis, então eles não participam de saldos de hidrólise para mudar a natureza da água. Exemplos desses sais são:
-NaCl, cloreto de sódio, libera íons Na+ e cl-
-Agno3, Nitrato de prata, liberação de íons Ag+ e não3-
-Irmão mais velho3, nitrato de sódio, liberação de íons Na+ e não3-
-K2SW4, Sulfato de potássio, libera os íons k+ Eu sou42-
-Mgcl2, Cloreto de magnésio, libera íons MG2+ e cl-
-CUSO4, Sulfato cúprico, libera íons cu2+ Eu sou42-
-KBR, brometo de potássio, libera K íons+ e br-
-NH4Cl, cloreto de amônio, libera íons NH4+, Cl-, H3QUALQUER+ e gás de amônia
Pode atendê -lo: cloreto de mercúrio (ii): estrutura, propriedades, obtenção, usos-NACN, cianeto de sódio, libera íons Na+ e cn-
-N / D3Po4, Fosfato de sódio, libera íons Na+ e Po43-
-CRCL3, Cloreto crômico, libera íons CR3+ e cl-
-AUB3, O brometo aurico, libera íons Au3+ e br-
-Sso4, Estany Sulfato, libera íons SN2+ Eu sou42-
O NH4CL é um exemplo contraditório: é completamente ionizado, mas ao mesmo tempo gera moléculas neutras de amônia porque é um sal ácido.
Diferenças entre eletrólito forte e fraco
Embora as diferenças entre um forte eletrólito de um fraco tenham sido estabelecidas indiretamente, elas serão apresentadas abaixo como uma conclusão:
-Os eletrólitos fortes são muito solúveis em águas; Eletrólitos fracos não são.
-A ionização de um eletrólito fraco é parcial, o que significa que pode haver moléculas neutras em solução. Em vez disso, eletrólitos fortes existem exclusivamente como íons.
-Os ácidos fracos e bases, que por sua vez são eletrólitos fracos, não se dissociam completamente na água, então eles geram menos íons h3QUALQUER+ ou oh- O que poderia ser esperado.
-Os eletrólitos fortes de Halth -halin quase não são hidrolisados em comparação com eletrólitos fracos. Portanto, as soluções do primeiro tendem a ser neutras, exceto quando lidam com sais ácidos ou básicos.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Eletrólito forte. Recuperado de: em.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (11 de fevereiro de 2020). Definição e exemplo de eletrólitos fortes. Recuperado de: pensamento.com
- Chung & Chieh. (5 de junho de 2019). Eletrólitos. Química Librettexts. Recuperado de: química.Librettexts.org
- « Características de avaliação externa, tipos (testes), exemplos
- Biografia Platão, Filosofia e Contribuições »

