Operação de eletrodo de calomel, características, usa

- 845
- 167
- Shawn Leffler
Ele Eletrodo de calomel O Calomelanes é um eletrodo secundário que permite determinar os potenciais semi -vida, graças à reação que ocorre entre Mercúrio e Mercúrio Cloreto (I), HG2Cl2, Anteriormente conhecido como Calomel. Ambos os reagentes, HG e HG2Cl2, Eles ganham ou perdem elétrons, dependendo do meio em que o eletrodo está imerso.
Normalmente abreviado como CE, esse eletrodo substitui muitas medidas ao eletrodo de hidrogênio padrão (She), pois é mais fácil de construir e menos arriscado de manipular (apesar de ter mercúrio). Dentro dele contém uma solução KCl como meio eletrolítico para fluxo de elétrons.
 Eletrodo de calomel em medição completa. Fonte: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons
Eletrodo de calomel em medição completa. Fonte: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons O eletrodo de calomel pode ter variantes diferentes, dependendo do seu tamanho, ou mais importante, da concentração de KCl. Quando a solução KCL é saturada, falamos sobre um electro do calomel de Saturado (ESC). O ESC é mais fácil de preparar do que a CE, mas mais sensível às mudanças de temperatura.
O uso deste eletrodo permitiu determinar os potenciais semi -vida de inúmeras reações redox. É também um dispositivo recorrente em determinações potenciométricas, que buscam saber a quantidade de analito, dependendo da célula e potencial medido.
[TOC]
Funcionamento
Para que o eletrodo de Calomel funcione, o par HG-HG2Cl2 Você deve reagir, seja ganhando ou perdendo elétrons.
Catódico
Quando a redução ou ganho de elétrons ocorre dentro do eletrodo de calomel, temos as seguintes reações:
Hg2Cl2 → Hg22+ + 2cl- (Ionizacao)
Hg22+ + 2e- → 2hg (redução)
Hg2Cl2 + 2e- → 2hg +2cl- (Reação líquida)
Pode atendê -lo: reação exotérmicaPortanto, o HG2Cl2 Ganhe elétrons reduzindo o mercúrio metálico.
O potencial e do eletrodo quando a redução ocorre é dada pela equação:
E = eº - 0.0591 LOG [CL-]
Onde é observado que depende exclusivamente da concentração dos íons cl-, sendo o potencial de redução padrão para esse eletrodo medido na frente do eletrodo de hidrogênio padrão.
Anódico
Dentro do eletrodo, também pode ocorrer um processo de oxidação:
2hg → hg22+ + 2e- (Oxidação)
Hg22+ + 2cl- → Hg2Cl2 (Precipitação)
2hg +2cl- → Hg2Cl2 + 2e- (Reação líquida)
Isto é, que Mercúrio oxida para gerar mais HG2Cl2.
O potencial e neste caso é dado por:
E = eº + 0.0591 LOG [CL-]
E novamente, e depende de [cl-].
Reação geral
A reação geral do eletrodo de Calomel é:
Hg2Cl2(s) + 2e- 2HG (L) + 2Cl-
O senso de equilíbrio dependerá do meio onde o eletrodo está em contato. O cl- Determine a solubilidade de HG2Cl2, que por sua vez tem um impacto na formação ou oxidação do HG.
E o potencial determinado para uma concentração especificada de íons cl- Será igual a:
Ecalomel = Egrade - Eboi
Sendo ecalomel O potencial que é relatado como uma referência em certas tabelas em potencial.
Características do eletrodo de calomel
Representação do semi
A semi -borda do eletrodo Calomel pode ser representada da seguinte maneira:
Pt | Hg | Hg2Cl2| Cl- (XM)
Onde apenas a concentração de íons cl-, expresso em molaridade ou normalidade. O potencial E do eletrodo varia se estiver preenchido com soluções de diferentes concentrações de KCl.
Por exemplo, um CE com KCl 0.1 m tem um e igual a 0.3356 V a 25 ° C; Enquanto o ESC, com KCl saturado, tem um e igual a 0.2444 V na mesma temperatura.
Pode atendê -lo: isopentano: estrutura, propriedades, usos, obtençãoPortanto, a concentração de KCl é a característica mais importante dos eletrodos de calomel, pois indicará o que usar quando os cálculos das medições potenciométricas forem realizadas.
Comercialmente, três tipos de eletrodos de calomel são alcançados: Saturados (ESC), o décimo nono (0.1 N ou 0.1 m kcl) e o normal (1 n ou 1 m kcl). Um eletrodo de Calomel 1 M KCl seria representado como:
Pt | Hg | Hg2Cl2| Cl- (1 m)
Festas
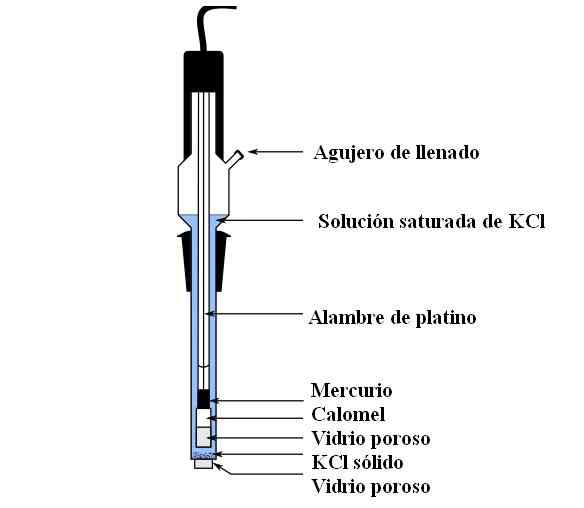 Peças de eletrodo de calomel. Fonte: Bachi-Bouzou, CC0, via Wikimedia Commons
Peças de eletrodo de calomel. Fonte: Bachi-Bouzou, CC0, via Wikimedia Commons Na imagem superior, mostramos as partes principais de um eletrodo de calomel comum. É feito de vidro e consiste em dois recipientes: um externo, que é colocado em contato eletroquímico com o meio das medições e contém a solução KCL; E um interno, onde a mistura HG-HG repousa2Cl2.
Internamente, o eletrodo Calomel contém mercúrio líquido, no qual uma pasta HG é aderida2Cl2 umedecido com mercúrio. Esta é a fase mais ativa do eletrodo. O vidro poroso é usado para permitir apenas a entrada ou saída dos íons cl-, Mas não os cristais de HG2Cl2 Ou Mercury cai.
Um cabo de platina, onde os elétrons fluem, é submerso em mercúrio e é responsável por conectar o eletrodo com o voltímetro e o circuito externo em questão.
Através do orifício de enchimento, a solução KCl é derramada, que contém desenrolos de sal dissolvido. Enquanto isso, na parte inferior do eletrodo, temos uma abertura muito pequena em um vidro poroso, que entra em contato direto com o meio de medições. O objetivo do vidro poroso é permitir o contato sem trocas indesejáveis de substâncias que contaminam o eletrodo ou a amostra.
Pode atendê -lo: ciclohexeno: estrutura, propriedades, síntese e usosVantagens
O eletrodo Calomel apresenta as seguintes vantagens em relação ao eletrodo de hidrogênio padrão:
-Fácil de construir e manipular
-Seu potencial celular permanece constante, mesmo que a água evapora
-Você não precisa de uma ponte salina
O ESC é o mais fácil de construir a partir de eletrodos de calomel, pois KCl é suficiente para se dissolver até que seus cristais sejam formados. Em seguida, a solução será saturada e pronta para derramar dentro do eletrodo.
Desvantagens
O eletrodo de Calomel, no entanto, apresenta as seguintes desvantagens:
-Ao conter mercúrio líquido, pode exercer um impacto negativo no meio ambiente
-Não pode ser usado para análises quantitativas em amostras com uma temperatura superior a 60 ºC, já que o HG2Cl2 começa a quebrar, fazendo com que as leituras de eletrodos falhem
O ESC também tem a desvantagem de que é muito sensível às mudanças de temperatura.
O eletrodo de prata prateado substituiu o calomel em muitas das determinações potenciométricas.
Formulários
O eletrodo de Calomel é um dos muitos eletrodos usados diariamente em determinações potenciométricas, permitindo obter os potenciais semi -vida de analitos ou espécies de interesse.
Além disso, o eletrodo de calomel é usado em medições de pH e voltmetril cíclica.
Referências
- Dia, r., & Underwood, um. (1986). Química analítica quantitativa (Quinta ed.). Pearson Prentice Hall.
- Wikipedia. (2020). Eletrodo de calomel saturado. Recuperado de: em.Wikipedia.org
- Geralic, Eni. (20 de outubro de 2018). Calomel de eletrodo. Dicionário de Química Croata-Inglaterra e Glossário. Ktf-split. 30 de outubro. 2020. Recuperado de: Glossário.Período.com
- Skoog d.PARA., Oeste d.M. (1986). Análise instrumental. (Segunda ed.). Inter -American., México.
- Hills, g., Ives, d. T. (1950). O eletrodo de calomel. Natureza 165, 530 doi.org/10.1038/165530A0
- Jmgav. (9 de dezembro de 2012). Potenciometria (ii): eletrodos. Recuperado de: Triplenlace.com
- « Características, métodos, representantes do paradigma socio -crítico
- Fundamentos da potenciometria, equações, eletrodos »

