Fundamentos da potenciometria, equações, eletrodos

- 684
- 181
- Melvin Mueller
O Potenciometria É uma técnica de análise eletroquímica baseada na medição da tensão, de um meio ou compartimento, com o qual a atividade ou concentração de uma espécie (iônica ou molecular) de interesse é determinada. É uma técnica não -destrutiva, porque não procura modificar a natureza química do analito em questão.
Para realizar esta análise, pelo menos dois eletrodos são indispensáveis: uma de referência e outro indicador ou trabalho. Da mesma forma, deve haver um voltímetro de alta impedância, com o qual as tensões são medidas sem permitir um fluxo de elétrons apreciável entre os dois eletrodos e as soluções que os cercam.
 Representação geral dos elementos necessários para uma análise potenciométrica. Fonte: Gabriel Bolívar.
Representação geral dos elementos necessários para uma análise potenciométrica. Fonte: Gabriel Bolívar. Acima, temos uma representação geral da Assembléia para uma análise potenciométrica. No compartimento em que o eletrodo indicador é introduzido é a espécie cuja concentração queremos determinar; Enquanto no eletrodo de referência, temos outra solução, na qual conhecemos as concentrações de seus componentes.
A leitura de tensão registrada é devida, em princípio, à espécie de interesse que se aproxima do eletrodo indicador. Com esta tensão, calculamos a concentração dessa espécie, por exemplo, a dos íons Ca2+, AG+, H+, N / D+, K+, Cl-, etc. A potenciometria tem usos, portanto, em química clínica, ambiental, analítica e físico -química.
[TOC]
Fundamentos
A tensão que é determinada nas análises potenciométricas é a da célula ecélula, que é a diferença entre as tensões causadas pelos dois eletrodos, o indicador e a referência. Os eletrodos são sensíveis às atividades das moléculas ou íons que os cercam, sendo capazes de aceitar elétrons deles, ou pelo contrário, os rendem.
Os dois compartimentos são conectados; portanto, o eletrodo flui onde a redução ocorre (cátodo), no eletrodo onde ocorre oxidação (ânodo) (ânodo).
No entanto, essa transferência de elétrons (ou corrente) é quase nula, uma vez que as reações redox evoluiriam para modificar completamente as concentrações e identidades das espécies envolvidas.
Pode atendê -lo: brometo de hidrogênio (HBR)Em vez disso, o voltímetro mal permite a passagem de elétrons, para que haja uma leitura estável de tensão e que a célula possa atingir o equilíbrio termodinâmico.
Diz -se, portanto, que a potenciometria é uma técnica não -destrutiva, porque poucos íons ou moléculas são transformados no processo de medição, que também é reversível.
Equações principais
Potencial celular
O potencial da célula está relacionado às atividades ou concentrações das espécies de interesse através da equação de Nernsnst:
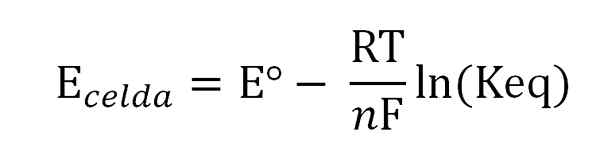 Equação de Nernst. Fonte: Gabriel Bolívar.
Equação de Nernst. Fonte: Gabriel Bolívar. Onde o eº é o potencial da mesma célula em condições padrão, f constante de Faraday, n O número de elétrons transferidos, r a constante de gás e keq a balança constante da reação global. Os cálculos são feitos limpando o keq da leitura de ecélula, e calcular a concentração desejada da sua expressão de equilíbrio.
No entanto, é conveniente calcular as concentrações por uma rota mais fácil. Por convenção, o potencial da célula também é dado pela seguinte equação:
Ecélula = Egrade- Eboi
Onde égrade É o potencial para a semi -media de redução, onde o eletrodo indicador está localizado; enquanto eboi É o potencial de oxidação semi -media, onde temos o eletrodo de referência. Assim, a equação pode ser reescrita como:
Ecélula = Eindicador - Ereferência + EJ
Sendo eJ igual ao potencial causado pelas articulações da ponte articular. Na prática eJ Não pode ser determinado, mas garanta que seu valor seja o mais mínimo possível usando soluções muito diluídas ou garantir que as composições em ambos os compartimentos sejam semelhantes.
Potencial do analito
Da equação anterior, podemos calcular eindicador, qual é o potencial que realmente nos interessa. Com esse valor, aplicamos a equação de Nernst novamente:
Pode atendê -lo: acetonitrila (C2H3N)Eindicador = Eº - (RT/NF) LN (vermelho/ox)
A rede é a forma reduzida do analito ou a espécie de interesse, e Ox é sua forma oxidada. Supondo que o analito seja o Zn Cátions Zn2+ Em um eletrodo metálico de zinco, teríamos:
Eindicador = EºZn2+/Zn - (RT/NF) LN (1/paraZn2+)
Onde paraZn2+ É a atividade de cátions do Zn2+, que, por ajustes experimentais, está bastante próximo de sua concentração, [Zn2+]. Desta equação, a concentração de Zn é limpa2+, como pode ser visto, afeta diretamente o valor de eindicador.
A forma reduzida de zinco, Zn, apresenta uma atividade igual a 1. Portanto, a equação geral para cátions enferrujados de um metal que age como um eletrodo será igual a:
Eindicador = EºMn+/m - (RT/NF) LN (1/paraM+n)
Mas isso se aplica apenas no caso de eletrodos de primeira espécie.
Eletrodos
Os eletrodos, além do voltímetro, são os elementos mais importantes de qualquer análise potenciométrica. Alguns deles serão mencionados abaixo.
Primeira espécie
Os primeiros eletrodos de espécies são metais que oxidam para causar cátions, conduzindo elétrons no voltímetro. Alguns deles são os seguintes: AG, Zn, Cu, HG, SN, TL, CD e BI.
Nem todos os metais servem como eletrodos de primeira classe, porque não devem apresentar irregularidades ou superfícies cristalinas cobertas por camadas de óxido que causam tensões instáveis.
Segunda espécie
Segunda espécie Os eletrodos, por outro lado, também são metálicos, mas também contêm um sal em sua superfície, cuja solubilidade depende das reações redox que ocorrem. Por exemplo, eletrodos ag-agl e hg-hg2Cl2 (Calomel), são eletrodos de segunda espécie.
Íons seletivos
Os eletrodos de íons seletivos, também conhecidos como membranas, são aqueles que são sensíveis a um íon ou molécula específica, que se esgueiram através de uma membrana projetada apenas para ele passar e não a outra espécie em solução.
Pode atendê -lo: reagente limitante e excessivoO exemplo favorito desse tipo de eletrodo é o de vidro, construído para determinar a concentração de íons h3QUALQUER+ ou h+, E assim serve como pehômetro.
Aplicações de potenciometria
Química Ambavomental
A potenciometria tem sido usada na química ambiental na determinação de íons CN-, F- e não3-, bem como amônia em correntes de água.
Química Clínica
Os eletrodos seletivos são muito úteis quando o meio de medição é complexo. Portanto, os outros íons ou moléculas interferirão nas leituras.
Essa característica é especialmente benéfica nas determinações potenciométricas realizadas dentro das mesmas células, onde os microeletrodos são injetados para determinar as concentrações de k k+, N / D+, Cl-, AC2+ ou h+.
Graus potenciométricos
Suponha que no meio onde tenhamos o eletrodo indicador, é adicionado um título que reage com o analito e, portanto, ele modifica sua concentração. Então as mudanças ocorrerão no ecélula, que corresponderão da mesma maneira à mudança de pH em uma titulação ácida-base.
Assim, gráficando ecélula vs. VTitulant, Podemos determinar o ponto de virada ou equivalência e, com isso, saberemos a concentração do analito.
Os graus potenciométricos são amplamente utilizados em laboratórios de química analítica e físico. Alguns dos analitos que podem ser determinados com esta técnica são os seguintes: fé2+, HCO3-, AC2+, Mg2+, Cu2+, ácido ascórbico, haluros, entre outros.
Todos os graus, até certo ponto, podem ser seguidos por potenciométricos em vez de recorrer aos indicadores e seus pontos finais.
Referências
- Dia, r., & Underwood, um. (1986). Química analítica quantitativa (Quinta ed.). Pearson Prentice Hall.
- Skoog d.PARA., Oeste d.M. (1986). Análise instrumental. (Segunda ed.). Inter -American., México.
- Dr. Doug Stewart. (2020). Definição de potenciometria. Recuperado de: Chemicool.com
- Harvey David. (5 de junho de 2019). Métodos potnométricos. Química Librettexts. Recuperado de: química.Librettexts.org
- Enciclopédia Britannica. (2020). Eletrogravimetria. Recuperado de: Britannica.com
- Wikipedia. (2020). Métodos eletroanalíticos. Recuperado de: em.Wikipedia.org
- « Operação de eletrodo de calomel, características, usa
- Tipos de drogas estimulantes e suas características »

