Qual é o elemento mais eletronegativo e por quê?
- 4730
- 130
- Melvin Mueller
 O elemento mais eletronegativo é o fluoreto (f), travado no círculo vermelho
O elemento mais eletronegativo é o fluoreto (f), travado no círculo vermelho Ele Mais elemento eletronegativo Na tabela periódica é o flúor, cujo produto químico é f e pertence ao grupo de halogênio. Entre todos os elementos da tabela periódica, o fluoreto está o mais ansioso para capturar elétrons de outros átomos.
Esse elemento, gasoso à temperatura ambiente, é altamente reativo e, portanto, não é fácil encontrá -lo em um estado puro na natureza. A fluorina se liga facilmente a outros elementos, como enxofre, cálcio e metais, além de numerosos compostos, especialmente aqueles que contêm hidrogênio.
Sua alta eletronegatividade permite que você se combine com gases nobres como xenônio, kripton e radon.
Após a flúor, o oxigênio é o segundo elemento com a maior eletronegatividade. Por outro lado, os elementos com a menor eletronegatividade são Frania (FR) e césio (CS).
 Por ser o elemento mais eletronegativo, a flúor forma numerosos compostos, como fluorita ou fluoreto de cálcio. Fonte: Wikimedia Commons
Por ser o elemento mais eletronegativo, a flúor forma numerosos compostos, como fluorita ou fluoreto de cálcio. Fonte: Wikimedia Commons Estes são, portanto, os mais Eletropositivo que existem, embora Frania seja radioativo e muito pouco abundante por natureza.
Eletronegatividade e tabela periódica
A escala da eletronegatividade foi desenvolvida pelo químico e prêmio Nobel Linus Pauling (1901-1994), embora o conceito seja devido ao químico sueco Jöns Jakob Berzelius (1779-1848).
A escala Pauling, que atribui valores numéricos dimensionais à eletronegatividade, é usada para medir a intensidade com a qual um átomo atrai o elétron de outro átomo diferente e, portanto, formam links.
Cada elemento tem sua própria eletronegatividade, que depende de suas propriedades atômicas. É determinado experimentalmente e indiretamente, por exemplo, medindo a energia do link, como Pauling fez por volta de 1932.
Na escala Pauling Electronegativities, o fluoreto é o primeiro, com um valor aproximado de 3.98 ≈ 4.0.
Pode servir a você: hidrocarbonetos alifáticos: propriedades, nomenclatura, reações, tiposEletronegatividade é uma propriedade periódica dos elementos. Na maioria dos casos (existem algumas exceções), observa -se que a eletronegatividade aumenta ao passar da esquerda para a direita através das fileiras da tabela periódica.
E também, aumente de baixo para cima, movendo -se em uma coluna.
 A tabela periódica de eletronegatividades de acordo com a escala Pauling. A flúor é o elemento mais eletronegativo, localizado acima e à direita, enquanto Frania é o menos eletronegativo de todos, ou o mais eletropositivo, se preferido, e está na coluna esquerda e para baixo. Fonte: f. Zapata.
A tabela periódica de eletronegatividades de acordo com a escala Pauling. A flúor é o elemento mais eletronegativo, localizado acima e à direita, enquanto Frania é o menos eletronegativo de todos, ou o mais eletropositivo, se preferido, e está na coluna esquerda e para baixo. Fonte: f. Zapata. Eletronegatividade fluorina
A razão pela qual a flúor é o elemento mais eletronegativo da tabela periódica é devido à sua configuração eletrônica (a maneira pela qual seus elétrons são dispostos em orbitais ao redor do núcleo).
Esta configuração é 1s22s22 p5, Portanto, o fluoreto tem 5 elétrons em sua camada mais externa.
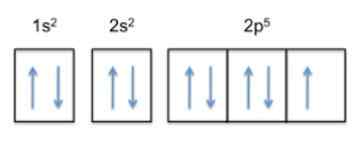
Agora, como a tendência do átomo é concluir sua camada externa, isso significa que o flúor aceitará um elétron de outros átomos com grande facilidade, a fim de obter estabilidade e se assemelhar ao gás nobre da mesma linha, que é o neon , cuja configuração eletrônica é 1s22s22 p6.
O átomo de flúor tem um raio muito pequeno, já que os prótons em seu núcleo atraem elétrons com muita força, mantendo -os mais próximos do que nos átomos de menos elementos eletronegativos, como Cessium e Francio.
Portanto, estes últimos estão dispostos a desistir de elétrons facilmente para formar links.
Referências
- Aguilar, c. Guia para a unidade de aprendizado químico i. Recuperado de: IPN.mx.
- Atkins, p. (2005). Princípios da química, os caminhos da descoberta. 3º. Edição. Editorial médico pan -American.
- Clark, j. Eletronegividade. Recuperado de: química.Librettexts.org.
- Hein, m. (2014). Fundamentos da química da faculdade. 14ª ed. Wiley.
- Lentech. Elementos químicos ordenados por sua eletronegatividade. Recuperado de: lentech.é.

