Ligação química
- 3048
- 894
- Lonnie MacGyver
Explicamos quais são os links químicos, os tipos que existem, e damos muitos exemplos
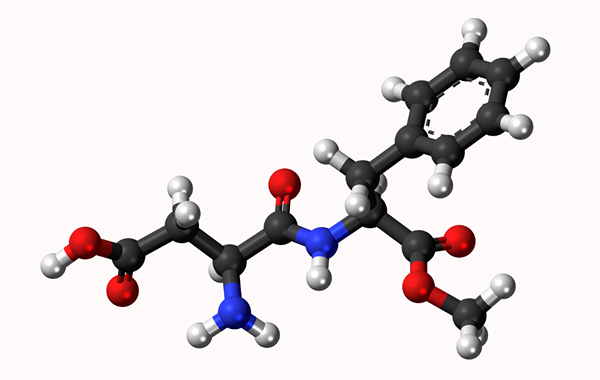
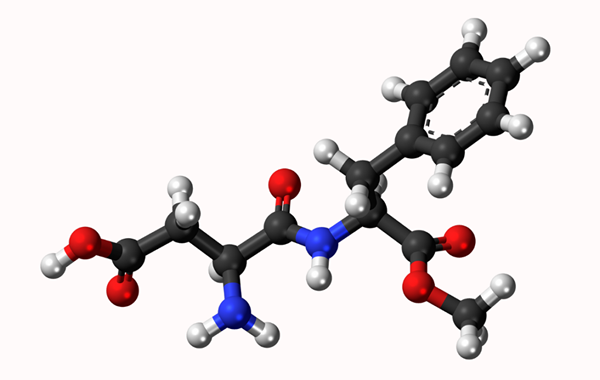 Modelo molecular de aspartamo: link simples representado por uma linha e ligação dupla por duas linhas. As bolas são átomos
Modelo molecular de aspartamo: link simples representado por uma linha e ligação dupla por duas linhas. As bolas são átomos O que é um vínculo químico?
A Ligação química É a força que se mantém junto com os átomos de um composto. A força que une átomos é eletromagnética e, quando os átomos estão ligados, eles mantêm sua própria natureza.
Por exemplo, a água comum é formada devido à união de dois átomos de hidrogênio (H2) e um de oxigênio (O); É por isso que sua fórmula química é H2QUALQUER. Embora estejam unidos para formar água, os átomos de hidrogênio permanecem hidrogênio e o oxigênio ainda é oxigênio.
Lembre -se de que os átomos são formados por um núcleo cercado por uma nuvem de elétrons, que têm uma carga negativa. O núcleo do átomo tem uma carga positiva, que consegue atrair elétrons.
No entanto, os elétrons também são atraídos pelos núcleos de outros átomos. É assim que os links químicos são formados. O fato de os átomos produzirem ou compartilharem elétrons gera os diferentes tipos de links químicos.
Nas ligações químicas, os átomos produzem, ganham ou compartilham elétrons do que é chamado de camada de valência, que é a camada mais externa de um átomo onde ocorre a reatividade ou a tendência de formar ligações químicas.
Esses links produzem novas substâncias (não misturas) que não podem ser separadas por meio de técnicas como peneira ou filtragem.
Tipos de ligação química
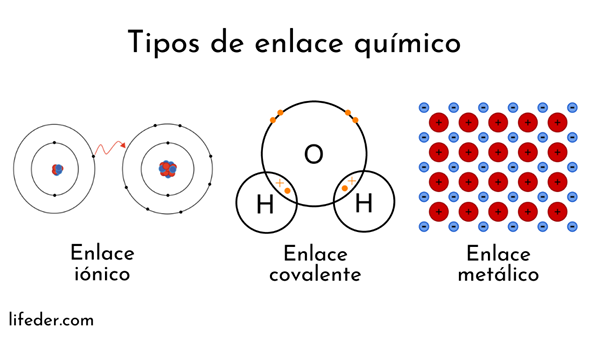
Os átomos são formados por um núcleo (com carga elétrica positiva) e elétrons (partículas com carga elétrica negativa) que giram em torno. Ambas as partes intervêm em ligações químicas.
As ligações químicas envolvendo núcleos atômicos são chamados de metálico. Por outro lado, aqueles que envolvem troca de elétrons são divididos em íons e covalentes.
Pode atendê -lo: clorobenzeno (C6H5Cl)Links iônicos
Este tipo de link é muito resistente; produz compostos químicos sólidos (cristais) na água e com um ponto de fusão alto (entre 300 e 1.000 graus Celsius). Dissolvido em água, são condutores de eletricidade.
Como estão os links iônicos?

As ligações iônicas ocorrem entre um metal e um não -metal que possui diferente eletronegatividade (capacidade de atrair elétrons). Os elétrons da camada de Valência de um átomo passam para o outro átomo de Valência. Que é o mesmo; Um átomo metálico fornece um elétron a um átomo não metálico, alcançando a estabilidade eletrônica.
Ao longo do processo de formação de links (cátions e ânions) são formados, daí o nome da ligação iônica.
Um exemplo desse tipo de ligação é o cloreto de sódio: este composto químico é formado quando o cloro (CL) atrai o elétron da camada de valência que tem o átomo de sódio (Na).
Outro exemplo é o cloreto de manganês (MGC), usado na fabricação de pinturas e desinfetantes. Como resultado da ligação química, os elétrons do átomo de manganês são absorvidos pelo átomo de cloro.
Links covalentes
As ligações covalentes são muito difíceis e geram compostos químicos insolúveis com alta temperatura de fusão (mais de 1.000 graus Celsius). Eles não conduzem eletricidade.
De acordo com a maneira como os átomos compartilham seus elétrons, as ligações covalentes podem ser:
- Simples: Eles compartilham alguns elétrons (A-A).
- Dobro: Compartilhe dois pares de elétrons (a =).
- Triplo: Compartilhe três pares de elétrons (Acer).
Como as ligações covalentes são formadas?

A ligação covalente é formada quando dois elementos não metálicos compartilham elétrons de sua camada de valência.
Pode servir a você: Rubidio: História, Propriedades, Estrutura, Obtenção, UsosA troca de elétrons sempre ocorre de tal maneira que está em conformidade com a lei do octeto. Este é um princípio químico que afirma que a configuração mais estável para um átomo é aquele em que possui oito elétrons em sua camada mais externa.
Um exemplo de ligação covalente é a água (h2QUALQUER). Para criar a molécula de água, são necessárias duas ligações covalentes simples. Em uma ligação simples, o hidrogênio elétron é compartilhado com oxigênio e o oxigênio compartilha um elétron com hidrogênio.
Outro exemplo de ligação covalente é o dióxido de carbono (CO2), um dos principais responsáveis pelo efeito estufa e mudança climática. Para formar esse composto, o carbono e o oxigênio criam duas ligações duplas, ou seja, para cada link, dois pares de elétrons compartilham.
Links de metal
Este tipo de link ocorre apenas em elementos de metal. Consiste na união dos núcleos de dois átomos do mesmo elemento metálico junto com seus elétrons.
Os links de metal são caracterizados por serem condutores de eletricidade eficazes, com um ponto de ebulição muito alto e de ebulição e facilmente oxidados. Eles também são maleáveis e resistentes a arranhões, muito sólidos e fortes.
Como são os links de metal?
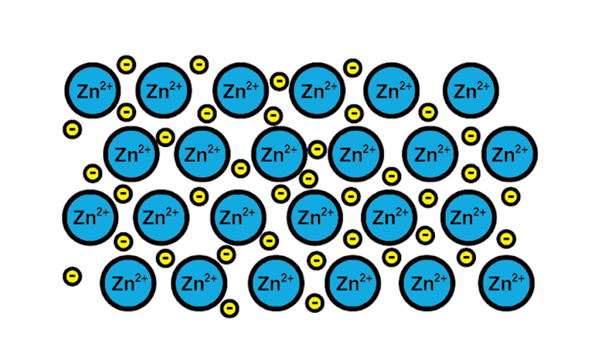 Link metálico de zinco
Link metálico de zinco Um exemplo de um link metálico é o de zinco, um elemento metálico. O processo de treinamento desse tipo de link é:
1-a núcleo atômico de um elemento metálico encontra outro núcleo do mesmo elemento.
2-Os elétrons da camada de Valência de ambos os núcleos se tornam um mar de elétrons ao redor. Isto é, eles não orbitam um único núcleo atômico.
3--cargas positivas dos núcleos atômicos e os negativos dos elétrons são atraídos. O resultado são elétrons de valência que formam o mar de elétrons ao redor dos núcleos atômicos (cátions).
Pode atendê -lo: sulfato de cobre (CUSO4): estrutura, propriedades, obtenção, usosExemplos de ligação química
Links iônicos
- Óxido de bário (BAO).
- Cloreto de magnésio (MGCL2).
- Óxido de cálcio (CAO)
- Nitrato de prata (AGNO3)
- Hidróxido de zinco (ZnOH2)
- Brometo de potássio (KBR)
- Carbonato de cálcio (caco3)
- Sulfato de cobre (CuO4)
- Fluoreto de lítio (LIF)
- Cloreto de manganês (MNCL2)
- Sulfato de potássio (K2SW4)
- Óxido de ferro (feio)
- Fosfato de dissódio (NA2HPO4)
- Ioduro de potássio (KI)
Links covalentes
- Dióxido de carbono (CO2)
- Amônia (NH3)
- Parafina (Cnh2N+2)
- Diesel (c12H26)
- Dibromo (Br2)
- Monóxido de carbono (CO)
- Butano (c4H10)
- Benzeno (c6H6)
- Nitrogênio molecular (n2)
- Metano (cap4)
- Ácido clorídrico (HCl)
- Ácido canífrico (HCN)
Links de metal
Qualquer metal em seu estado puro é um exemplo de um link metálico, a saber:
- Níquel (NI)
- Ferro (fé)
- Alumínio (AL)
- Titânio (TI)
- Chumbo (PB)
- Cobalto (CO)
- Cobre (Cu)
- Zinco (Zn)
- Mercúrio (HG)
- Ouro (AU)
- Prata (AG)
- Bário (BA)
Importância de ligações químicas
A importância das ligações químicas é que elas formam moléculas orgânicas e inorgânicas e, dessa maneira, fazem parte da base de todos os organismos vivos. Se eles estiverem sujeitos a certas condições, esses links podem ser quebrados. Esta energia é chamada Link Energy.
Algumas das técnicas para quebrar os links são aplicadas por eletricidade, altas temperaturas ou reações químicas provocadoras com diferentes compostos.
Por exemplo, para separar as moléculas de oxigênio e hidrogênio de H2Ou, podemos aplicar eletricidade à água, que é o processo conhecido como eletrólise.
Os compostos químicos formados pelo link estão numerosos e estão presentes na vida cotidiana. O sal que usamos para temperar os alimentos é um produto composto químico do vínculo entre um átomo de sódio (Na) e um cloro (Cl) (CL). Sua fórmula química é NaCl, que lê o cloreto de sódio.

