Coprecipitação
- 1348
- 31
- Orlando MacGyver
O que é coprecipitação?
O Coprecipitação É a precipitação de um sólido que arrasta substâncias normalmente solúveis e que ocorrem dentro do sólido ou na superfície ao mesmo tempo que este precipitado.
Visto dessa maneira, você pode gerar contaminação de uma substância insolúvel que carrega solutos dissolvidos do meio líquido. A palavra 'poluição' é aplicada aos casos em que solutos solúveis precipitados por suporte insolúvel são indesejáveis, mas quando não são, é um método analítico ou sintético alternativo.
Por outro lado, o suporte insolúvel é a substância precipitada. Isso pode transportar o soluto solúvel dentro (absorção) ou em sua superfície (adsorção). A maneira como mudará completamente as propriedades físico -químicas do sólido resultante.
Embora o conceito de coprecipitação possa parecer um pouco confuso, é mais comum do que se pensa, uma vez que mais do que simples sólidos contaminados, soluções sólidas de estruturas complexas e ricas em componentes inestimáveis são formados. A terra da qual as plantas são nutridas é um exemplo de coprecipitação.
Da mesma forma, minerais, cerâmica, argilas e impurezas no gelo também são um produto desse fenômeno. Caso contrário, os solos perderiam grande parte de seus elementos essenciais, os minerais não seriam como são conhecidos, e também não haveria um método importante para a síntese de novos materiais.
Exemplo de coprecipitação
Para entender melhor a idéia de coprecipitação, o exemplo a seguir é oferecido.
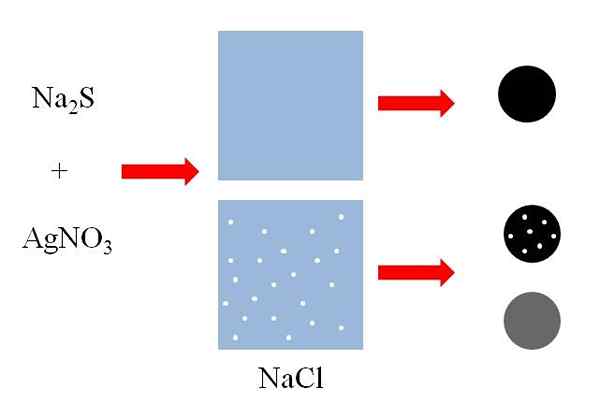
 Exemplos de coprecipitação. Fonte: Gabriel Bolívar
Exemplos de coprecipitação. Fonte: Gabriel Bolívar Top (imagem superior) Existem dois recipientes com água, dos quais um contém NaCl dissolvido. NACL é um sal de sal altamente solúvel, mas os tamanhos dos pontos brancos são exagerados para fins explicativos. Cada ponto branco se tornará pequenos agregados de NaCl em uma solução para a borda da saturação.
Pode atendê -lo: Fermio (FM)Adicionado a ambos os recipientes, uma mistura de sulfeto de sódio, NA2S e nitrato de prata, agno3, Precipitará um sólido enxofre de prata preta insolúvel, AGS:
N / D2S + agno3 => AGS + Nano3
Como pode ser visto no primeiro recipiente com água, um sólido preto (esfera preta) precipita. No entanto, esse sólido no recipiente de NaCl dissolvido carrega partículas deste sal (esfera preta com pontos brancos). A NaCl é solúvel em água, mas quando a AGS precipita, adsorve na superfície preta.
Dizem então que o NACL co -conciptou sobre o AGS. Se o sólido preto fosse analisado, os microcistionais de NaCl poderiam ser observados na superfície.
No entanto, esses cristais também podem estar dentro dos AGs, então o sólido "ficaria" cinza (branco + preto = cinza).
Tipos de Coprecipitação
A esfera negra com pontos brancos e a esfera cinza mostram que um soluto solúvel pode coprecipitar de maneiras diferentes.
No primeiro, o faz superficialmente, adsorvido no suporte insolúvel (AGS no exemplo anterior), enquanto no segundo o faz internamente, "mudando" a cor preta do precipitado.
Outros tipos de sólidos podem ser obtidos? Isto é, uma esfera com fases pretas e pretas, isto é, da AGS e NACL (junto com Nano3 isso também coprecipita). É aqui que surge a ingenuidade da síntese de novos sólidos e materiais.
No entanto, retornando ao ponto inicial, basicamente o soluto solúvel de coprecipita gerando diferentes tipos de sólidos. Os tipos de coprecipitação e os sólidos que resultam deles serão mencionados abaixo.
Pode atendê -lo: materiais que têm pouca resistência à passagem da eletricidadeInclusão
Fala -se de inclusão quando, na rede cristalina, um dos íons pode ser substituído por algumas das substâncias solúveis co -concipitadas.
Por exemplo, se o NACL tivesse copiado através da inclusão, os íons Na+ Eles teriam ocupado o lugar do AG+ Em uma seção do arranjo cristalino.
No entanto, de todos os tipos de coprecipitação, isso é menos provável, pois, para que ocorra, os rádios iônicos devem ser muito semelhantes. Voltando à esfera cinza da imagem, a inclusão seria representada por um dos tons cinza mais claros.
Como mencionado, a inclusão é dada em sólidos cristalinos e, para obtê -los, domínio da química das soluções e vários fatores (t, pH, tempo de agitação, relações molares, etc.).
Oclusão
Na oclusão, os íons estão presos na rede cristalina, mas sem substituir nenhum íon do arranjo. Por exemplo, dentro dos AGs, você pode formar cristais ocluido. Graficamente, pode ser visualizado como um cristal branco cercado por cristais pretos.
Esse tipo de coprecipitação é um dos mais comuns e, graças a ele, há a síntese de novos sólidos cristalinos. Partículas oblúmicas não podem ser eliminadas com lavagens simples. Para fazer isso, seria necessário recristizar todo o conjunto, ou seja, o suporte insolúvel.
Tanto a inclusão quanto a oclusão são processos de absorção fornecidos em estruturas cristalinas.
Adsorção
Em adsorção, o sólido co -concipitado está na superfície do suporte insolúvel. O tamanho das partículas desse suporte define o tipo de sólido obtido.
Pode atendê -lo: isóbarosSe forem pequenos, será obtido um sólido coagulado, do qual é fácil eliminar impurezas. Mas se forem muito pequenos, o sólido absorverá quantidades abundantes de água e será gelatinoso.
Voltando à esfera preta com pontos brancos, os cristais de NaCl co -concipitados no AGS podem ser lavados com água destilada. Assim, até purificar os AGs, que podem estar aquecendo para evaporar toda a água.
Aplicações do Coprecipitação
Algumas das aplicações de coprecipitação são as seguintes:
- Permite quantificar substâncias solúveis que não são facilmente precipitadas do meio. Assim, através de um apoio insolúvel, leva, por exemplo, isótopos radioativos, como Frania, para estudos e análises posteriores.
- Ao copregar íons em sólidos gelatinosos, o meio líquido está sendo purificado. A oclusão é ainda mais desejada nesses casos, uma vez que a impureza não será capaz de escapar.
- A coprecipitação torna possível incorporar substâncias em sólidos durante sua formação. Se o sólido for um polímero, ele absorverá solutos solúveis que então co -concipitarão por dentro, dando -lhe novas propriedades. Se for celulose, por exemplo, o cobalto (ou outro metal) pode ser feito para coprecipita.
- Além de tudo isso, a coprecipitação é um dos principais métodos para a síntese de nanopartículas em um suporte insolúvel. Graças a isso, bionanomateriais e nanopartículas de magnetita foram sintetizadas, entre muitos outros.
Referências
- Precipitação e co-precipitação. Nptel se recuperou.AC.em
- O que é coprecipitação. Recuperado de Wisegeek.com

