Velocidade constante

- 1602
- 401
- Lonnie MacGyver
Qual é a velocidade constante?
O velocidade constante É uma constante de proporcionalidade da lei de velocidade da cinética química, que estabelece uma relação entre a concentração molar dos reagentes e a velocidade da reação.
Como os reagentes, as velocidades de reação consomem, também diminuem. É por isso que nos cálculos da constante de velocidade, representados pelo símbolo 'K', as velocidades iniciais são levadas em consideração, para ter um ponto de comparação entre vários experimentos.

A cinética química indica que essa constante depende das ordens de reação dos reagentes, cujas concentrações estarão alterando a velocidade da reação. Por outro lado, de acordo com a equação de Arrhenius, K também depende da temperatura e energia de ativação para a reação.
É por isso que se diz que a constante de velocidade não é uma constante verdadeira, pois varia com a temperatura e também com a presença de catalisadores que modificam a energia de ativação. Portanto, não há muitas tabelas onde elas vêm para reações (e condições) específicas.
Por exemplo, para uma reação em que A e B reagem, cada um com uma ordem de reação de 1, a constante relatou k a 25 ° C e, com a adição de uma certa quantidade de catalisador, não será o mesmo se a reação é feito a uma temperatura de 26 ou 27 ºC. A menor variação afetará o valor de k, que é apenas constante durante as condições estabelecidas para experimentos.
Como calcular a velocidade constante?
Experimentação
A determinação do valor da constante de velocidade de uma reação é feita experimentalmente. Se, por exemplo, você deseja determinar o valor da constante de velocidade para uma reação do formulário:
A +B → C
Para o estabelecimento do valor de K, três reações podem ser feitas, com as seguintes diferenças: na reação 2 a concentração inicial de reagente A é constante, [a], mas é dobrada, por exemplo, a concentração de reagente B, [ B].
Enquanto isso, na reação 3 [a] é dobrada em comparação com a reação 1, mantendo constante [b].
Assim, será construída uma tabela de concentrações que servirá para comparar as velocidades iniciais entre várias experiências. Isso com o objetivo de determinar ordens de reação e consecutivamente calcular a constante de velocidade.
Pode atendê -lo: hidróxido de alumínio: estrutura, propriedades, usos, riscosOrdens de reação
Primeiro cálculo
Para a reação anterior, sua velocidade é expressa pela equação:
Velocidade da reação = k · [a]x· [B]e
Onde 'x' e 'e' correspondem às ordens de reação para os reagentes A e B, respectivamente.
Para determinar os valores das ordens de reação, uma comparação entre a reação 2 e 1, bem como entre a reação 3 e 1 deve ser feita.
Ao comparar a reação 1 com o 2, pode -se observar, por exemplo, que, duplicando [b], há uma duplicação da velocidade da reação.
Então: a proporção de [b] entre as reações 2 e 1 é 2, bem como a proporção entre as velocidades das reações. Em seguida, o valor da ordem da reação pode ser obtido em relação a B (expoente e), através da seguinte abordagem:
 Cálculo da ordem da reação 'e'. Fonte: Gabriel Bolívar.
Cálculo da ordem da reação 'e'. Fonte: Gabriel Bolívar. A velocidade do experimento 2 é duas vezes mais rápida que a velocidade do experimento 1. Assim, dividindo as duas equações acima, teremos:
2 = 2e
Portanto, 'e' Vale 1, sendo capaz de concluir que a ordem da reação em relação ao reagente B é da primeira ordem.
Segundo cálculo
Da mesma maneira, prosseguimos com o reagente A para o cálculo de 'x':
 Cálculo da ordem de reação 'x'. Fonte: Gabriel Bolívar.
Cálculo da ordem de reação 'x'. Fonte: Gabriel Bolívar. A velocidade do experimento ou reação 3 é quatro vezes maior que o experimento ou reação 1. Portanto:
4 = 2x
QUALQUER
22 = 2x
E o valor de x é 2, então a reação é a segunda ordem em relação ao reagente a.
Compensação final
Então, o valor da constante de velocidade com base em qualquer uma das reações pode ser estabelecida:
Velocidade da reação = k · [a]2· [B]
O suficiente para introduzir valores experimentais e claro k:
K = velocidade de reação / ([a]2· [B])
Exemplos
Os exemplos a seguir servem como uma introdução antes dos exercícios resolvidos a partir da seção a seguir.
Exemplo 1
Em uma reação química:
a) Se a concentração inicial de um reagente for dobrada a velocidade da reação: qual é a ordem da reação em relação a este reagente?
b) Se o aumento da concentração do reagente causar um aumento na velocidade em um fator de 8, qual seria a ordem de reação então?
c) Se a concentração do reagente experimenta uma mudança e a velocidade permanecer a mesma: qual é a ordem da reação em relação ao reagente?
Pode atendê -lo: Cycopropano (C3H6)Em a) a proporção de velocidades de reação é a mesma e a proporção de concentrações de reagentes é igual a 2x,
2 = 2x
Portanto, x = 1 e a ordem da reação em relação ao reagente é 1.
Em b) a proporção da velocidade de reação é a mesma 8 (23) e a proporção de concentrações de reagente é igual a 2x,
23 = 2x
Portanto, x = 3 e a ordem da reação em relação ao reagente é 3-
Enquanto em c) a velocidade da reação é independente da concentração do reagente, portanto a ordem da reação em relação ao reagente é zero.
Exemplo 2
A reação:
2 não2 + QUALQUER2 → 2 não2
Tem a expressão da seguinte lei de velocidade:
Velocidade de reação = k · [não2]2·QUALQUER2.
Qual é a ordem global da reação? Que unidades K teria?
A ordem da reação a respeito ou2 É 1, e a ordem da reação em relação a não2 É 2, então a ordem global da reação é a soma desses valores, ou seja, 2 + 1 = 3.
A velocidade da reação tem unidades m/s, e as concentrações dos reagentes são expressas em m. Fazendo uma análise das unidades que teremos:
k = velocidade de reação / (não2]2·[QUALQUER2]
= (M / s) / (M3)
= s-1M-2
Exercícios resolvidos
Exercício 1
Os dados da reação a seguir foram obtidos a 25 ° C:
A +2 B → C +2 D
Qual é a expressão da lei de velocidade desta reação? Qual é o valor da sua velocidade constante?
Cálculos de ordens de reação
Os dados experimentais são:
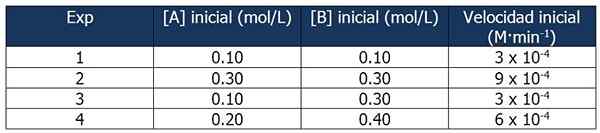 Dados cinéticos do Exercício 1. Fonte: Gabriel Bolívar.
Dados cinéticos do Exercício 1. Fonte: Gabriel Bolívar. A comparação dos experimentos 1 e 3 permite tirar as seguintes conclusões:
Proporção entre as velocidades das reações 3 e 1:
3 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 1
Mas a proporção entre as concentrações B é:
(0.3 mol / l) / (0.1 mol/l) = 3
A velocidade da reação é independente da concentração de B, uma vez que seu aumento não o afeta. Portanto, a ordem da reação em relação ao reagente B é zero.
Por outro lado, a comparação das reações 4 e 1 permite as seguintes conclusões:
6 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 2
Enquanto isso, a proporção entre [a] de reações 4 e 1 é igual a:
Pode atendê -lo: 5 características de misturas homogêneas(0.20 mol / l) / (0.10 mol/l) = 2x
Então a relação entre as proporções será:
2 = 2x
x = 1
Portanto, a expressão da lei de velocidade é:
Velocidade da reação = k · [a]
B não é levado porque sua ordem da reação é zero.
Cálculo de k
Podemos calcular a velocidade constante de qualquer um dos dados cinéticos. Vamos usar o experimento 1:
K = velocidade de reação / [a]
= 3 x 10-4 M · min-1 / 0.10 m
= 3 x 10-3 ou 0.003 min-1
Exercício 2
Os dados da velocidade de reação foram obtidos em uma determinada temperatura.
2 clo2 (AC) +2 oh- (AC) → CLO3- (AC) +CLO2 (AC) +H2Ou (l)
Cálculos de ordens de reação
Os dados experimentais são:
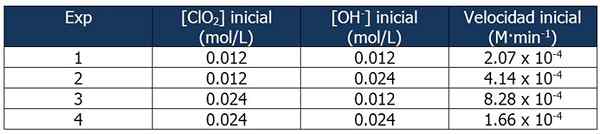 Dados cinéticos no Exercício 2. Fonte: Gabriel Bolívar.
Dados cinéticos no Exercício 2. Fonte: Gabriel Bolívar. A proporção entre as velocidades da reação 2 e a reação 1 é:
4.14 x 10-4 M · min-1 / 2.07 x 10-4 M · min-1 = 2
E a proporção de concentrações de OH- Entre as reações 2 e 1 é igual a:
(0,024 mol/L)/(0,012 mol/L) = 2x
O expoente 'x' representa a ordem da reação em relação ao reagente OH-. A relação entre proporções calculadas pode ser representada da seguinte forma:
2 = 2x
x = 1
Portanto, a ordem da reação em relação ao reagente OH- é igual a 1.
Na reação 3, a concentração de clo é dobrada2 da reação 1, enquanto a concentração de OH- Permanece constante.
Proporção entre as velocidades das reações 3 e 1:
(8.28 x 10-4 M · min-1) / (2.07 x 10-4 M · min-1) = 4 (22)
E a proporção de [CLO2] entre as reações 3 e 1 é igual a:
(0,024 mol/L)/(0,012 mol/L) = 2e
O expoente 'e' representa a ordem da reação em relação ao reagente CLO2.
Comparando as proporções:
22 = 2e
4 = 2e
y = 2
Portanto, a reação é o segundo em relação ao reagente CLO2.
A expressão da lei de velocidade será então:
Velocidade da reação = k · [clo2]2· [Oh-]
Cálculo de k
Novamente, podemos calcular k a partir da expressão anterior usando qualquer um dos dados cinéticos para os experimentos. Usaremos a Experiência 3:
K = (8.28 x 10-4 M · min-1) / (0.024 m)2 (0.012 m)
= 119.79 min-1· M-2
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Wikipedia. (2020). Taxa de reação constante. Recuperado de: em.Wikipedia.org
- Química Texas A&M University. (s.F.). Cinética: cálculos da taxa de amostragem. Recuperado de: química.Tamu.Edu
- Keith J. Descontraído. (2020). Taxa de reação. Enciclopédia Britannica. Recuperado de: Britannica.com
- Helmestine, Anne Marie, Ph.D. (25 de agosto de 2020). Qual é a taxa constante na química? Recuperado de: pensamento.com
- Clark Jim. (2013). Constantes de taxa e a equação de Arrhenius. Recuperado de: Chemguide.co.Reino Unido

