Composto químico
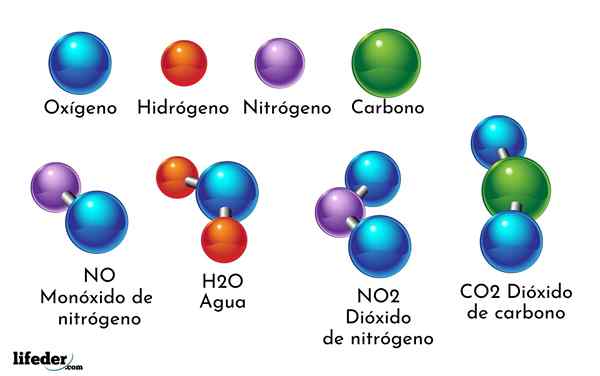
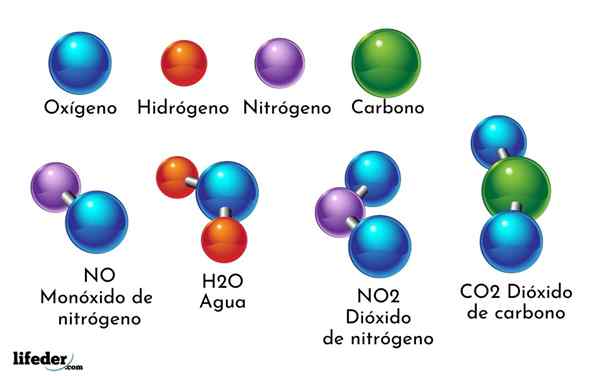
- 4339
- 511
- Melvin Mueller
Explicamos em que compostos químicos consistem nos tipos que existem, as diferenças com os elementos químicos e dão vários exemplos.
 Compostos químicos são toda essa substância que possui átomos de dois elementos químicos diferentes
Compostos químicos são toda essa substância que possui átomos de dois elementos químicos diferentes O que é um composto químico?
A composto químico É uma substância formada pela união de dois ou mais átomos de diferentes elementos químicos. Os compostos químicos permanecem unidos graças às ligações químicas, relacionadas aos elétrons dos átomos vinculados; isto é, em um composto químico, os elétrons (mais externos) dos átomos intervêm na formação dos links.
Os componentes dos compostos químicos (elementos químicos) não podem ser separados um do outro por métodos físicos, como: destilação, centrifugação, filtração, etc., exigindo métodos químicos em vigor para alcançá -lo.
Um exemplo de composto químico é água. É formado por apenas dois átomos de dois elementos químicos diferentes: oxigênio e hidrogênio, com a fórmula química H2QUALQUER. Portanto, dois h se ligam a um ou para formar H2QUALQUER.
Um elemento químico, diferentemente dos compostos químicos, é a maneira mais simples e básica que constitui a matéria. É apresentado como um tipo único de átomo que não pode ser dividido em substâncias mais simples por reações químicas.
Tipos de compostos químicos
Os compostos químicos podem ser classificados principalmente após dois critérios:
- De acordo com o tipo de ligação que une os elementos químicos presentes no composto químico.
- De acordo com a composição e estrutura do composto químico.
De acordo com o tipo de link
Dependendo do tipo de link, os compostos químicos podem ser:
- Moléculas. São compostos químicos formados por dois ou mais tipos de elementos químicos diferentes, que são unidos por uma ligação covalente. Este link é caracterizado pelo compartilhamento de um ou mais pares de elétrons externos, ou Valência, entre dois átomos.
- Íons. Compostos químicos carregados eletricamente são chamados de compostos químicos de íons, e seus íons são unidos pelo Link iônico. Esta ligação ocorre ao ingressar em um elemento químico do tipo de metal com um elemento químico não -metal.
- Compostos intermetálicos. É um tipo de liga de metal que constitui um material sólido que está entre dois ou mais elementos químicos metálicos para mantê -los juntos.
- Coordenação. Eles são formados por um elemento metálico central, chamado Centro de Coordenação, e que cercam um conjunto de moléculas ou íons unidos conhecidos como ligantes. A hemoglobina, por exemplo, é uma proteína encontrada nos glóbulos vermelhos e transporta oxigênio no sangue. A hemoglobina tem um composto de coordenação chamado Grupo Hemo. No centro do Hemo, há um átomo de ferro que intervém no transporte de oxigênio através da hemoglobina.
De acordo com a composição e estrutura
De acordo com esse critério, os compostos químicos são classificados como orgânicos e inorgânicos.
- Compostos orgânicos. São compostos cujo principal elemento químico é o carbono, que geralmente se liga aos átomos do mesmo carbono e hidrogênio. No entanto, eles também estão presentes, embora, em menor grau, oxigênio, nitrogênio, enxofre, boro, fósforo, etc. Os compostos orgânicos podem ser:
- Alifático. As moléculas dos compostos alifáticos podem ter formas lineares ou cíclicas, ou seja, em formas fechadas, como triângulos, quadrados, pentagons, etc. Eles podem ter ligações de carbono de três tipos: simples (c-c), duplo (c = c) ou triplo (c≡C).
- Aromático. São compostos cíclicos que alternadamente apresentam ligações simples de carbono-carbono e ligações de carbono duplo.
- Heterocíclico. São compostos que têm uma estrutura cíclica, que pode apresentar a substituição de um átomo de carbono por outro elemento químico (O, S, N, etc.).
- Organometálico. São compostos orgânicos que podem apresentar em seus elementos de metal de composição.
- Polímeros. São moléculas grandes (macromoléculas) formadas por unidades pequenas e idênticas que são repetidas em todo o polímero e que são chamadas de monômeras.
- Compostos inorgânicos. Compostos inorgânicos, diferentemente dos orgânicos, não têm carbono como elemento químico central, mas intervêm em sua composição a maioria dos elementos químicos conhecidos. Os compostos inorgânicos podem ser:
- Óxidos básicos. Eles são formados pela reação de um elemento químico de metal, como sódio, cálcio, ferro, cobre, etc., Com oxigênio. Por exemplo, o óxido de sódio (NaO) é um óxido básico. Eles são chamados de óxidos básicos porque darão origem às bases ou hidróxidos.
- Óxidos ácidos. Eles se originam pela reação de um elemento químico não metálico, como cloro, flúor, enxofre, bromo, etc., Com oxigênio. Por exemplo, óxido bromico (BR2QUALQUER5) É um óxido ácido. Eles são chamados de óxidos ácidos porque dão origem a ácidos.
- Hidratantes. Eles apresentam em sua composição química a presença de hidrogênio. Existem dois tipos: hidros metálicos e hidratantes não metálicos.
- Metal. Eles são formados pela reação de hidrogênio, com o estado de oxidação -1, com um metal. Esses compostos químicos são os únicos em que o hidrogênio está presente com o estado de oxidação -1. Por exemplo, CAH2 É hidreto de cálcio.
- Não metálico. Eles são formados pela reação de hidrogênio, com estado de oxidação + 1, com um elemento não -metálico com seu estado de oxidação mais baixo. O hidreto de cloro (HCl) é um gás que quando o ácido clorídrico é dissolvido em água.
- Ácidos. Eles são compostos químicos inorgânicos, embora existam ácidos orgânicos, que têm um pH menor que 7 e se voltam para a cor de papel vermelho -vermelho para vermelho. Eles podem ser classificados em hidracídeos e oxácidos.
- Hidratia. Eles se originam da reação de hidrogênio com um não -metal para formar um hidreto que se dissolve na água origina um ácido; Por exemplo, ácido iarhídrico (HI).
- Oxcacids. Ele se origina da reação de um óxido de um elemento químico não metálico com água. Por exemplo, reação de óxido sulfúrico (então3) Com água produz ácido sulfúrico (H2SW4).
- Você sai. São compostos químicos que se originam pela interação de ácido e compostos básicos. Em sua composição, pode haver tantos elementos de metal quanto não -metálico. Os sais são classificados como:
- Sais neutros. Eles se originam em uma reação de neutralização entre um ácido e uma base com a formação de sal e água. Por exemplo, a reação de hidróxido de sódio (NaOH) com ácido clorídrico (HCL) produz cloreto de sódio (NaCl), sal e água. Eles são chamados de neutro porque não produzem uma variação de pH.
- Sais ácidos. Eles são formados pela reação de um hidróxido de metal com Valência +1, com um ácido com vários hidrogênios. A reação do hidróxido de lítio (lioh) com ácido carbônico (H2Co3), produz a substituição de apenas um hidrogênio por lítio, que causa o bicarbonato de lítio (Lihco3), Um sal ácido e água.
- Sais básicos. Eles são produzidos pela reação de uma base que possui mais de um grupo OH com um ácido hidracente, por exemplo, ácido clorídrico. Ao reagir ácido com hidróxido de cálcio, CA (OH)2, Um átomo de cloro substitui um grupo hidroxila (OH). Isso produz hidroxicloreto de cálcio (cuckloh), um sal e água básicos.
Diferenças entre compostos químicos e elementos químicos
 Até os elementos químicos e os compostos químicos. Os compostos químicos são formados pelos elementos acima
Até os elementos químicos e os compostos químicos. Os compostos químicos são formados pelos elementos acima Cada elemento químico corresponde a um átomo específico e apenas com esse tipo de átomo; isto é, um elemento químico não tem tipos diferentes de átomos. O átomo é a partícula elementar da matéria que não é dividida por métodos físicos ou químicos.
O átomo de um elemento químico pode ser unido com os átomos de outros elementos químicos para formar compostos químicos, que podem ser separados em seus componentes (elementos químicos) usando métodos químicos.
Os elementos químicos e compostos químicos com um quebra -cabeça podem ser equipados: as peças do quebra -cabeça têm características diferentes, para que possam corresponder aos elementos químicos.
As peças do quebra -cabeça podem unir para formar figuras diferentes. Os números formados podem ser equiparados a compostos químicos. Uma vez que a atividade termine, as figuras do quebra -cabeça podem ser separadas nas peças que a constituem.
Exemplos de compostos químicos
Abaixo, você pode ver uma série de exemplos de compostos químicos diários:
- HCL: Ácido clorídrico
- H2S: ácido sulfidrico
- HF: ácido fluorífrico
- H2SW4: Ácido sulfúrico
- HCLO4: Ácido perclórico
- H3Po4: Ácido fosfórico
- H2Co3: Ácido carbónico
- Hno3: Ácido nítrico
- NaOH: hidróxido de sódio
- CA (OH)2: Hidróxido de cálcio
- Fé (oh)2: Hidróxido ferroso
- Fé (oh)3: Hidróxido férrico
- Nah: hidreto de sódio
- Cu2O: óxido cuprove
- Cuo: óxido cúprico
- Fé2QUALQUER3: Óxido férrico
- Cl2QUALQUER7: Óxido perclórico
- Br2O: óxido hipobromoso
- Yo2QUALQUER3: Óxido de hipoiodose
- NaCl: cloreto de sódio
- FECL3: Cloreto férrico
- HCO3: Bicarbonato de Sódio
- CH3Caminho: acetato de sódio
- N / D2SW4: Sulfato de sódio
- Feso4: Sulfeto ferroso
- H2O: Água
- Co2: Dióxido de carbono
- C6H12QUALQUER6: Glicose
- C12H22QUALQUERonze: Sacarose
Outros tópicos de interesse
Reações químicas
Química na vida cotidiana: exemplos
Compostos orgânicos
Compostos inorgânicos
Ligação química
Substâncias puras
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Wikipedia. (2021). Composto químico. Recuperado de: em.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (27 de agosto de 2020). Definição de composto em química. Recuperado de: pensamento.com
- Toppr. (s.F.). O que é composto na química? Tipos de composto químico. Recuperado de: TOPPR.com

