Ácido silícico
- 2871
- 198
- Lonnie MacGyver
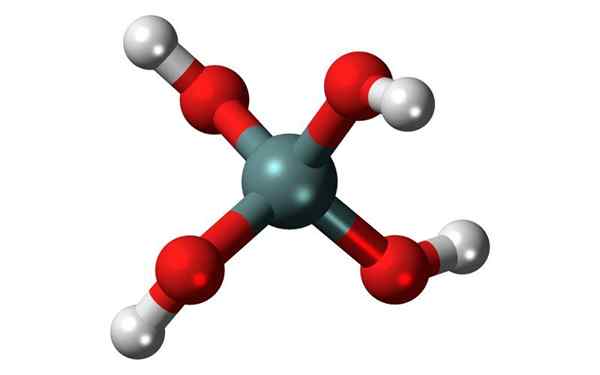
 Estrutura química do ácido ortosílico, o mais comum de silicics. Fonte: Jynto, CC0, Wikimedia Commons
Estrutura química do ácido ortosílico, o mais comum de silicics. Fonte: Jynto, CC0, Wikimedia Commons O que é ácido silícico?
Ele Ácido silícico É uma forma hidratada de óxido de silício. É o nome geral da família de compostos químicos formados por silício, anexado a óxido ou grupos hidroxila.
A fórmula geral desses ácidos é [siox(OH)4-2X]n, E a maneira mais comum pela qual geralmente é encontrada é a do ácido ortossílico, h4SiO4.
O ácido silícico faz parte da família de silicatos diversos. Isso significa que o maior oxoanion de metal é silicato e que nenhum átomo não -metálico está unido.
Existem alguns casos isolados em que eles têm um átomo não metálico, mas nunca mais de um.
Propriedades físicas do ácido silícico
- O ácido silícico existe apenas em dois estados, amorfo e cristalino. O primeiro é obtido por um processo de precipitação e o segundo é apresentado como cristal de rocha.
- Ácido silícico, em sua forma amorfa (sio3), é branco, sem sabor, insolúvel em água e não se forma com moléculas de si mesmo qualquer massa coesa plástica, como com alumínio.
- Em seu estado cristalino, não é dissolvido por nenhum oxácido. Quando uma solução muito diluída de solução de sílica é tratada com ácido sulfúrico, nítrico ou clorídrico, o ácido silícico não é precipitado. Em vez disso, parece estar dissolvido na água como um hidrato.
- Quando uma solução ácida ou ácida para uma solução de silicato é adicionada, o hidrato é precipitado em uma forma juntil, que, ao secar e subsequentemente aquecer com muita energia, torna -se uma substância insolúvel.
Pode atendê -lo: ácido de enxofreReações químicas
O ácido silícico é extremamente fraco e só perde seu primeiro próton ao se aproximar do pH 10. Apenas 3 reações com este ácido são conhecidas em condições fisiológicas normais de vida.
- A reação consigo mesmo, quando a solubilidade é excedida para formar hidrato de sílica amorfa.
- Sua reação com hidróxido de alumínio para formar hidróxido de silicato de alumínio.
- Reação excedente de Molibdato para formar heteropolicídeos, como silicomolibdato.
Onde está o ácido silícico?
Após oxigênio, o silício é o elemento mais comum da natureza. É na forma de cristais. Quando está em um ambiente aquoso, torna -se não -ionizante, então o sal de silício de silício.
Os suprimentos líquidos de ácido silícico no oceano mundial foram encontrados em 6,1 ± 2,0 terramoles de silício por ano (1 terramol = 1012 moles). Quase 80% dessa contribuição vem dos rios, cuja concentração média mundial é de 150 micromolar (concentração de água).
Nos sedimentos marinhos modernos, os rendimentos líquidos de silício biogênico (transformação de silicato dissolvido em material esquelético em partículas) é 7 é 7.1 ± 1.8 Teramoles por ano.
A produção de sílica biogênica de bruta em águas superficiais é de 240 ± 40 terramoles de silício por ano e a taxa de preservação (acumulação de opalas em sedimentos / produção bruta em águas superficiais) é de 3%.
Na flora, pode ser encontrado na planta Borago officinalis (borragem), que em sua composição apresenta até 2,2% de ácido silícico.
Pode atendê -lo: acetato de sódio: estrutura, propriedades, síntese, usosO ácido ortosílico é a forma mais comum de ácido silícico, que pode ser encontrado em lugares diferentes. As maiores fontes biodisponíveis desse ácido são encontradas em água, seja em água do mar ou outras bebidas, como cerveja.
Para obter o laboratório, o mesmo princípio é seguido como no oceano: pode ser obtido pela acidificação do silicato de sódio em uma solução aquosa.
Usos na vida cotidiana
Pasta de dentes
É o gel abrasivo usado na pasta de dente, ou na parte clara da pasta dentária de Rayada, pois em combinação com carbonato de cálcio, ajuda a remover com segurança a placa com a escovação.
É registrado como um composto seguro na Food & Drug Administration dos Estados Unidos e não possui toxicidade ou carcinogenicidade conhecida.
Dessecante
Quando seco em um forno, perde a água e se torna um dessecante (substância que atrai o ar do ar). Portanto, você pode encontrar pequenos pacotes de cristais de sílica gel em recipientes cujo conteúdo pode ser danificado pela umidade, como garrafas de vitaminas, eletrônicos, sapatos ou produtos de couro.
Outros usos
Pode ser encontrado em lojas de presentes, como pedras mágicas, jardim químico ou jardim de vidro. Sua forma seca é misturada com sais de diferentes metais.
Ao jogar na água, o sódio é substituído pelo metal e, como o silicato de metal não é solúvel em água, um precipitado da cor característica do metal é formado. O silicato metálico também se expande como gel e cresce como estalagmites coloridos na água.
Pode atendê -lo: hidróxido de níquel (iii): estrutura, propriedades, usos, riscosBenefícios médicos do ácido ortosílico (OSA)
O ácido ortosílico é o melhor silício biodisponível para humanos. Isso pode ser usado para tratar várias condições de saúde, como doença de Alzheimer, artrite, aterosclerose, hipertensão, doenças cardíacas, osteoporose ou derrame.
Saúde óssea
Estudos científicos indicam que o ácido ortossílico estimula a produção de colágeno (proteína encontrada no tecido conjuntivo) e na promoção do desenvolvimento de células de formação óssea.
Saúde do cabelo
Da mesma forma, evidências científicas sugerem que esse ácido pode ajudar a melhorar a qualidade do cabelo e a saúde. Este ácido pode aumentar a força do cabelo e da espessura. Em geral, a qualidade do cabelo melhora com suplementos de ácido ortosalicílico.
Referências
- Centro Nacional de Informações sobre Biotecnologia. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Graham, t. (1863). Nas propriedades do ácido silícico e outras substâncias coloidais análogas. Anais da Sociedade Real de Londres. Recuperado do jstor.org.
- Composto químico de ácido silícico. Recuperado da Britannica.com.

