Estrutura do ácido perracético, propriedades, obtenção, usos
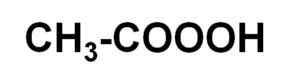
- 4823
- 184
- Ernesto Bruen
Ele ácido peracético É um composto orgânico líquido cuja fórmula química é c2H4QUALQUER3. É peróxido de ácido acético, por isso é também conhecido como ácido perxiacético. Sua molécula é semelhante à do ácido acético CH3Cooh, mas com um oxigênio adicional em carboxil.
Pertence à classe de peróxidos orgânicos, que são moléculas feitas pelo homem. As propriedades germicidas e esterilizantes de suas soluções aquosas são conhecidas desde 1902. Esta ação pode, em alguns casos, exercitá -la em concentrações tão baixas quanto 0,001%.
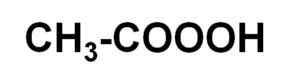 Ácido peracético. Autor: Marilú Stea.
Ácido peracético. Autor: Marilú Stea. Essa propriedade o torna amplamente utilizado em clínicas e hospitais para esterilizar equipamentos médicos, com a vantagem adicional de que seus produtos de decomposição não são tóxicos para o ser humano.
As soluções PAA são fortemente oxidantes, uma característica que tem sido usada para branquear polpa ou lavanderias. Também se aplica à execução de reações químicas nas quais essa propriedade é necessária, como epoxidação e hidroxilação.
Sua ação oxidante e desinfetante usou na limpeza de equipamentos onde alimentos e bebidas são processados. Além disso, é corrosivo para alguns metais e, quando armazenado, deve ser mantido longe de compostos orgânicos ou facilmente oxidáveis.
Consulte que suas soluções concentradas podem ser explosivas, e é por isso que deve se preparar de preferência e armazenado em lugares frios. Sua força corrosiva também se aplica à pele, membranas mucosas e tecidos do ser humano, por isso deve ser manipulado com cautela e com equipamentos de proteção.
[TOC]
Estrutura
O ácido perxiacético tem uma molécula muito semelhante à do ácido acético, mas com um oxigênio adicional na estrutura do grupo -cooh, pois possui 3 átomos de oxigênio em vez de dois.
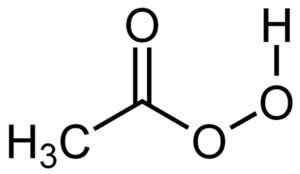 Estrutura do ácido peracético. Autor: Su-no-G. Fonte: Selfmade. Fonte: Wikipedia Commons.
Estrutura do ácido peracético. Autor: Su-no-G. Fonte: Selfmade. Fonte: Wikipedia Commons. Nomenclatura
- Ácido peracético
- Ácido perxiacético
- Ácido etonooooperoxóico
- PAA (sigla inglesa Ácido peroxacético).
Propriedades
Estado físico
Líquido incolor claro com um cheiro agudo de vinagre.
Peso molecular
76,05 g/mol
Ponto de ebulição
110 ºC (com explosão)
Ponto de inflamação
40,5 ºC (método de copo aberto)
Temperatura de autodirecionamento
200 ºC (é a temperatura em espontaneamente)
Densidade
1.226 g/cm3 a 15 ºC
Gosma
3.280 cp a 25,6 ºC
Índice de refração
1.3974 a 20 ºC
Solubilidade
É miscível com água em qualquer proporção. É solúvel em solventes orgânicos polares, como etanol. Ligeiramente solúvel em solventes aromáticos. Muito solúvel em éter e ácido sulfúrico.
ph
Menos de 2.
Constante de dissociação
Pkpara = 8,20 a 25 ºC (é mais fraco que o ácido acético que PK tempara = 4.8)
Propriedades quimicas
Como ácido, o PAA é muito mais fraco que o ácido do qual o ácido acético vem.
Apresenta alto potencial como oxidante. É altamente reativo, por isso é difícil de armazenar e isso limitou seu uso.
Seus produtos de degradação são ácido acético CH3COOH, oxigênio ou2, Peróxido de hidrogênio h2QUALQUER2 e água h2QUALQUER. O h2QUALQUER2 Por sua vez, se degrada em água e oxigênio. Todos esses compostos são ambientalmente seguros.
É um agente epoxidante e hidroaxilato para ligações olefínicas (links duplos c = c). Isso significa que participa ativamente da formação de epóxidos em ligações duplas de moléculas orgânicas e na adição de grupos -Oh nestes.
O PAA é corrosivo para alguns metais, como aço liso, ferro galvanizado, cobre, latão e bronze. Outros metais são resistentes, como aço inoxidável, alumínio puro e ferro de lenço de tecido.
Pode atendê -lo: composto químicoAtacar gengivas sintéticas e naturais e extrair o plastificante de alguns polímeros de vinil.
Tem um cheiro nítido e acre que lembra o do ácido acético (o ácido acético é o principal componente do vinagre).
Obtenção
Ao reagir ácido acético glacial (anidro, isto é, sem água) com peróxido de hidrogênio H2QUALQUER2 Na presença de um ácido mineral (como o ácido sulfúrico H2SW4), parte de soluções oxidadas e aquosas de ácido acético de ácido de pertura, ácido acético e H são obtidas2QUALQUER2.
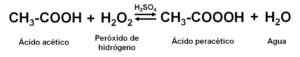 Obtenção de soluções aquosas de pernte ácido. Autor: Marilú Stea
Obtenção de soluções aquosas de pernte ácido. Autor: Marilú Stea O h2SW4 atua como um catalisador ou acelerador de reação. Agentes estabilizadores são usados, como piridina-2,6-dicarboxílico ácido.
Se essas soluções forem destiladas, uma maior concentração de permissão pode ser obtida.
Também pode ser obtido por oxidação de acetaldeído ch3Cho com ozônio ou3, ou por reação de anidrido acético (CH3CO)2Ou com h2QUALQUER2.
Outra maneira de obtê-lo no local onde é necessário é adicionar tetra-acetil-etilendiamina (Taed) a uma solução alcalina de H2QUALQUER2.
Formulários
Na medicina como esterilizador de equipamentos
O PAA atua como um desinfetante de equipamentos médicos em clínicas, hospitais, consultórios médicos e odontológicos.
 Equipamento dental esterilizado. Autor: Daniel Frank. Fonte: pexels.
Equipamento dental esterilizado. Autor: Daniel Frank. Fonte: pexels. Algumas fontes relatam que sua ação contra microorganismos pode ser classificada e: bactérias> vírus> esporos de bactérias> cistos protozoários. Isso significa que é mais eficaz contra bactérias e menos eficaz contra cistos protozoários.
Nos estudos realizados sobre a ação bactericida do PAA e outros desinfetantes de alto nível contra Staphylococcus aureus e Pseudomonas aeruginosa Em equipamentos para endoscopia, o PAA provou ser o mais rápido em seu efeito de microbicida.
Ele Staphylococcus aureus Pode produzir infecções em tecidos moles, na pele, pneumonia e infecção de tecidos cardíacos. O Pseudomonas aeruginosa Pode produzir pneumonia.
As bactérias formam biofilmes que os protegem de estímulos ou estresse externos, através de uma espessa camada de proteínas extracelulares, polissacarídeos e ácidos nucleicos.
Esses biofilmes são altamente resistentes a antibióticos e desinfetantes comuns. Em equipes como os endoscópios, geralmente são formados em seus canais estreitos, devido a rotinas de limpeza e desinfecção não adequadas ou não efetivas.
O PAA ataca esses biofilmes provavelmente pela oxidação das ligações moleculares mais sensíveis de proteínas, enzimas e outros metabólitos. Isso leva à ruptura das paredes celulares dos germes, seus esporos e cistos.
Além disso, ao penetrar na célula, o PAA pode oxidar enzimas essenciais, prejudicando o transporte de moléculas e processos bioquímicos vitais.
Os tempos de desinfecção foram estabelecidos por alguns anos, mas durante certos estudos observaram -se que o tratamento com PAA causou alterações na forma das células após apenas 5 minutos, com formação de bolsas ou protuberâncias na parede celular das bactérias e colapso do celular Estruturas de microorganismos após 30 minutos.
Embora o PAA se destacasse por sua velocidade, os pesquisadores recomendaram reavaliar os tempos estabelecidos nos protocolos de limpeza e desinfecção, aumentando -os para a maioria dos anti -sépticos de alto nível, para garantir a eficácia total destes.
Um dos aspectos negativos do PAA é que existem alguns patógenos para os quais não é muito eficaz, como os cistos do Giardia Lamblia e de Cryptosporidium parvum (Parasitas que podem produzir diarréia ou outras condições intestinais).
Em tratamento de águas residuais
O efeito desinfetante do PAA nas águas residuais ou indústrias municipais foi investigado por mais de 30 anos.
Pode servir a você: hidreto de potássio: estrutura, formação, propriedades Estação de tratamento de água residual. Autor: Michal Jarmoluk. Fonte: Pixabay.
Estação de tratamento de água residual. Autor: Michal Jarmoluk. Fonte: Pixabay. Entre suas vantagens está o amplo espectro de sua atividade germicida, mesmo na presença de matéria orgânica, bem como o fato de que nenhum produto secundário prejudicial é gerado para o ambiente.
A eficácia de sua ação parece depender entre outros fatores da quantidade de matéria orgânica presente no efluente, do tipo e quantidade de microorganismos a serem eliminados, na concentração do PAA na água a ser tratado, o pH e o pH e o duração do tratamento.
Em alguns casos, o PAA se mostrou melhor que o hipoclorito de sódio para desinfetar as águas residuais em climas tropicais e tem sido eficaz contra o vírus da cólera, entre muitos outros patógenos.
No entanto, um dos pontos negativos é que, devido ao restante ácido acético após a desinfecção, o efluente da água é carregado com matéria orgânica, o que aumenta o risco de novo crescimento de microorganismos.
Por outro lado, é um produto caro, por isso ainda não é muito competitivo, por exemplo, com hipoclorito de sódio devido a esse aspecto.
Na indústria de alimentos
Ser um forte agente oxidante é muito eficaz contra os microrganismos a baixas temperaturas e isso deu origem ao seu amplo uso como bactericida e fungicida no processamento de alimentos e bebidas.
Isso inclui plantas de processamento de carne e frango, laticínios, cervejarias, enólogos ou vinícolas de vinho e refrigerantes. Em todos esses lugares, o PAA se aplica por ser ideal para limpar No local (no lugar).
As enzimas encontradas em alguns alimentos, como peroxidase e catalase, que desativam o peróxido de hidrogênio H2QUALQUER2, Eles não exercem efeito prejudicial no ácido pertence o ácido. O desperdício de proteínas também não prejudica.
Devido ao fato de que, nos alimentos, o PAA se decompõe em ácido acético e hidrogênio hidrogênio, seu uso é considerado seguro em aplicações nas quais os alimentos não são enxaguados.
Serve como desinfetante e esterilizante para tanques de aço inoxidável e vidro, tubos e caminhões de tanques, que servem para o transporte e armazenamento de bebidas.
 Tanques de aço inoxidável para armazenar cerveja. Autor: Roberta Keiko Kitahara Santana. Fonte: UNSPASH.
Tanques de aço inoxidável para armazenar cerveja. Autor: Roberta Keiko Kitahara Santana. Fonte: UNSPASH. Sua característica de gerar produtos não -toxicos e que, em alta diluição, não produz sabores ou odores, constituem economia de tempo e dinheiro para essas indústrias.
Na indústria de celulose e papel
O ácido perracético é um importante agente livre de cloro na tecnologia de clareamento na indústria de produção de celulose em papel.
Alguns autores consideram o ácido peracético como um derivado ativado de H2QUALQUER2, Onde um dos hidrogênios disso foi substituído por um grupo ACILO CH3C (= O)-.
Como resultado disso, o ácido de pernte reage com substratos orgânicos em maior grau do que H2QUALQUER2 e isso pode ser usado em reações de oxidação em condições mais moderadas do que com H2QUALQUER2.
Sob condições neutras ou moderadamente alcalinas, o peracetato de íons CH3C (= o) oo- Por ser um nucleófilo forte (é atraído por átomos deficientes em elétrons), mexem cromóforos seletivamente ou compostos coloridos presentes na polpa do papel.
Isso permite que essas indústrias tenham uma alvejante muito eficaz e cujos resíduos não poluem seus efluentes aquosos.
Pode atendê -lo: o que é o erristenoo?Na produção de outros compostos químicos
O ácido perracético serve como um oxidante para preparar compostos epóxi, como um catalisador para fazer resinas de poliéster e obter caprolactama e glicerol.
Na recuperação de polímeros para reciclar
Alguns pesquisadores conseguiram recuperar materiais úteis ao tratar certos resíduos poliméricos com soluções PAA.
O processo é realizado pela oxidação de certos desperdícios de polímeros reforçados com fibra de carbono de atividades aeroespaciais, com soluções de ácido acético glacial e peróxido de hidrogênio.
Dessa forma, o ácido pernte é gerado No local, que decompõe a resina epóxi em 97% deixando intacta a fibra de carbono.
Então, por destilação, mais de 90% do ácido acético é recuperado, resultando na decomposição adicional do polímero que gera compostos alifáticos e fenólicos recuperáveis.
A fibra de carbono é obtida limpa e mantém sua resistência de comprimento e tração comparável à das fibras virgens.
 Fibra de carbono. CJP24 [domínio público]. Fonte: Wikipedia Commons.
Fibra de carbono. CJP24 [domínio público]. Fonte: Wikipedia Commons. O processo é realizado em condições suaves, sem emissões gasosas, o que o torna ecológico.
Na lavanderia
Devido ao seu poder oxidante dos compostos coloridos, o ácido peracético é usado no branqueamento. Nesses casos, a mistura Tetra-Athil-Etilendiamina com H é usada2QUALQUER2 Em meio alcalino para obtê -lo no site.
Seu intervalo de aplicação é muito amplo, pois pode ser usado em águas duras ou que contêm alta proporção de sais de cálcio e magnésio, a pH entre 3,0 e 7,5 e temperaturas de 0 a 40 ° C.
Riscos
Ácido perracético ou PAA pode ser altamente corrosivo. É fortemente irritante para a pele e os olhos.
Se suas soluções forem ingeridas, causa corrosão das membranas mucosas da boca, garganta, esôfago e trato gastrointestinal, causando dor e dificuldade em engolir.
Se seus vapores são inalados.
Soluções contêm. Eles podem se decompor explosivamente. Se a concentração de PAA em solução exceder 56%, pode desencadear devido à evaporação violenta do ácido acético.
O calor deve ser evitado. É considerado um líquido inflamável. Sua decomposição é violenta com explosão a 110 ºC. Deve ser armazenado em lugares frescos, de preferência sob resfriamento ou em lugares muito bem ventilados.
É fortemente oxidante, portanto, perigoso em contato com materiais orgânicos. Quando armazenado, deve ser isolado de outros compostos, especialmente compostos orgânicos, combustíveis, inflamáveis ou oxidáveis. Deve ser separado de ácidos, álcalis e metais pesados.
Quando aquecido para decomposição emite acres e vapores irritantes, que irritam os olhos, nariz e garganta.
Se for derramado, não deve fluir para os drenos, porque neles um perigo de fogo ou explosão é criado.
Como medidas preventivas para manuseio, luvas de borracha e roupas de proteção, escudo facial ou proteção ocular (copos ou copos de segurança), proteção respiratória e não comer, beber ou fumar durante o trabalho com suas soluções são recomendados.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Ácido peracético. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Das, m. et al. (2018). Um método eficiente de reiclamar de resíduos de CFRP usando ácido peracético. ACS Sustainable Chemistry & Engineering. Recuperado de bares.ACS.org.
- Chinês, t. et al. (2017). Efeitos bactericidas morfológicos de ação rápida de ácido peracético, um desinfetante de alto nível, contra Staphylococcus aureus e Pseudomcas aeruginos Biofilmes na tubulação. Controle de infecção de resistência ao antimicrob. 2017: 6: 122. NCBI se recuperou.Nlm.NIH.Gov.
- Pão, g.X. et al. (1999). A reatividade do ácido ferúlico e seu deriva para pose de hidrogênio e ácido perácico. J. Agric. Food Chem. 1999, 47, 3325-3331. Recuperado de bares.ACS.org.
- Kitis, Mehmet. (2004). Dissinfecção de águas residuais com ácido peracético: uma revisão. Environment International 30 (2004) 47-55. Recuperado de cientedirect.com.
- « Estrutura do ácido fenilacético, propriedades, usos, efeitos
- Características de pensamento vertical, método e exemplos »

