O que é dissulfúrico o que é, estrutura, propriedades, usa
- 4310
- 688
- Melvin Mueller
O que é ácido dissulfúrico?
Ele ácido dissulfúrico É um dos muitos oxoácidos de enxofre, cuja fórmula química é h2S2QUALQUER7. A fórmula indica explicitamente que existem dois átomos de enxofre e, como o nome também aponta, deve haver duas moléculas H2SW4 apenas um; No entanto, existem sete oxigênio em vez de oito, então um enxofre deve ter três.
Este ácido é como um dos principais componentes do óleo (ou ácido sulfúrico de fumaça), que se torna uma forma "densa" do ácido sulfúrico. Tal é a sua predominância, que alguns consideram o petróleo como sinônimo de ácido dissulfúrico; que também é conhecido pelo nome tradicional do ácido pirossulfúrico.
Na imagem, é mostrado um destinatário com óleo, com uma concentração de trióxido de enxofre, então3, 20 %. Esta substância é caracterizada por ser oleosa e incolor; Embora amarelado ou marrom possa se tornar amarelo, dependendo da concentração do SO3 e da presença de algumas impurezas.
O acima relata a participação do SO3 em h2S2QUALQUER7; isto é, uma molécula H2SW4 Reaja com um dos3 Para formar ácido dissulfúrico. Sendo então H2S2QUALQUER7 Também pode ser escrito como H2SW4· SW3.
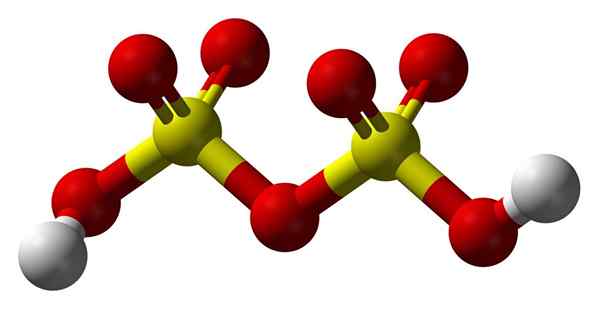
Estrutura do ácido dissulfúrico
 Estrutura do ácido dissulfúrico
Estrutura do ácido dissulfúrico Acima2S2QUALQUER7 Em um modelo de esferas e bares. Observe a simetria da molécula: o lado esquerdo da ponte de oxigênio é idêntico à direita. A partir dessa perspectiva, a estrutura pode ser descrita com a fórmula HO3Brando3H.
Em ambas as extremidades, cada grupo hidroxila, cujo hidrogênio, por efeito indutivo de todos os átomos de oxigênio, aumenta sua carga parcial positiva; E consequentemente, o ácido dissulfúrico tem acidez ainda mais forte que o ácido sulfúrico.
Pode atendê -lo: hidróxido de potássio: estrutura, propriedades, usosA molécula pode ser escrita como H2SW4· SW3. No entanto, isso se refere mais a uma composição do oleum do que à estrutura de uma molécula.
No entanto, se uma molécula de água for adicionada a H2S2QUALQUER7, Duas moléculas H serão liberadas2SW4:
H2S2QUALQUER7 + H2Ou 2h2SW4
O equilíbrio pode se mover para a esquerda: para a formação de H2S2QUALQUER7 De h2SW4 Se o calor for fornecido. É por esse motivo que h2S2QUALQUER7 Também é conhecido como ácido pirossulfúrico; já que pode ser gerado após o aquecimento do ácido sulfúrico.
Além disso, como mencionado no começo, h2S2QUALQUER7 É formado pela combinação direta de h2SW4 Eu sou3:
SW3 + H2SW4 H2S2QUALQUER7
Propriedades
 Oleum. Fonte: w. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)], via Wikimedia Commons
Oleum. Fonte: w. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)], via Wikimedia Commons As propriedades do ácido dissulfúrico não são muito bem definidas, porque é extremamente difícil ser isolado puramente do óleo.
Deve -se lembrar que pode haver outros compostos no óleo, com h h2SW4· Xso3, Onde dependendo do valor de x pode até ter estruturas poliméricas.
Uma maneira de visualizá -lo é imaginar que a estrutura superior de H2S2QUALQUER7 torna -se mais alongado por mais unidades de So3 e pontes de oxigênio.
Em um estado quase puro, consiste em um sólido cristalino instável (fumar) que derrete a 36ºC. No entanto, esse ponto de fusão pode variar dependendo da verdadeira composição.
O ácido dissulfúrico pode formar o que é conhecido como dissulfatos (ou pirossulfato) sais. Por exemplo, se você reagir com hidróxido de potássio, forme pirossulfato de potássio, k2S2QUALQUER7.
Além disso, pode -se comente+ que pode ser neutralizado com uma base forte).
Pode atendê -lo: volatilizaçãoReação de desidratação do açúcar
Com este composto em forma de óleo, uma reação curiosa pode ser realizada: a transformação de pedaços de bloqueio de carbono.
O h2S2QUALQUER7 Ele reage com os açúcares eliminando todos os seus grupos OH na forma de água, que favorece novos sindicatos entre os átomos de carbono; sindicatos que acabam causando carvão preto.
Nomenclatura
O ácido dissulfúrico é considerado como o anidrido de ácido sulfúrico; Isto é, perde um produto da molécula de água da condensação entre duas moléculas de ácido. Antes de tantos nomes possíveis para este composto, a nomenclatura da IUPAC simplesmente recomenda a do ácido dissulfúrico.
O termo 'piro' alude exclusivamente ao formado como um produto da aplicação de calor. IUPAC não aconselha esse nome para H2S2QUALQUER7; Mas ainda é usado por muitos químicos.
O término -ico permanece invariável, pois o átomo de enxofre continua a manter uma valência de +6. Por exemplo, pode ser calculado pela seguinte operação aritmética:
2h + 2s + 7o = 0
2 (+1) + 2s + 7 (-2) = 0
S = 6
Formulários
Armazena ácido sulfúrico
O ácido dissulfúrico, dado sua propriedade para solidificar como um óleo, é capaz de dissolver e armazenar ácido mais com segurança sulfúrico. Isso é porque o SO3 escapa criando um "neblina" irrespirável, que é muito mais solúvel em h2SW4 do que na água. Para obter h2SW4, Seria suficiente para adicionar ao óleo de água:
H2S2QUALQUER7 + H2Ou 2h2SW4
Síntese de ácido 100% sulfúrico
Da equação anterior, H2SW4 Está diluído na água adicionada. Por exemplo, se você tiver uma solução aquosa de H2SW4, Onde o SO3 Tende a escapar e representa um risco para os trabalhadores, adicionando petróleo à solução que reage com a água formando mais ácido sulfúrico; isto é, aumentando sua concentração.
Pode atendê -lo: impenetrabilidade químicaSe resta alguma água, mais é adicionado3, que reage com H2SW4 para produzir mais ácido ou óleo dissulfúrico e depois hidrata novamente "secando" o h2SW4. O processo repete às vezes o suficiente para obter ácido sulfúrico em uma concentração de 100%.
Um processo semelhante é usado para obter 100% de ácido nítrico. Da mesma forma, tem sido usado para desidratar outras substâncias químicas, usadas para elaboração explosiva.
Sulfonação
Estruturas, como corantes; isto é, adicione grupos -so3H, que perder o próton ácido pode ser ancorado ao polímero de fibra têxtil.
Por outro lado, a acidez do oleum é usada para alcançar a segunda nitração (adicione grupos -no2) para os anéis aromáticos.
Referências
- Química Inorgânica. (quarta edição). Mc Graw Hill.
- Ácido pirossulfúrico. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- « 20 invenções do renascimento que mudaram o mundo
- Manchas bacterianas O que é, características e preparação »

