Manchas bacterianas O que é, características e preparação
- 3303
- 10
- Shawn Leffler
Ele Mancha bacteriana É uma extensão na forma de um filme fino de uma suspensão de microorganismos bacterianos que são feitos em uma placa de vidro ou deslize transparente, para observação sob um microscópio óptico.
A extensão na forma de um filme é realizada para separar os microorganismos o máximo possível, pois se a observação for agrupada não estiver clara.
No estudo das técnicas de culturas bacterianas, manchas, fixação e preparação para coloração são usadas para analisá -las melhor. Devido ao pequeno tamanho dos microorganismos, o uso de um microscópio óptico para observação é necessariamente necessário.
Microscópios ópticos são instrumentos indispensáveis para a observação do mancha. Eles usam lentes ópticas e luz, permitindo a visualização de amostras com grande aumento de tamanho.
Em geral, as células vivas não possuem estruturas principais, as vistas do microscópio óptico são amostras incolores e transparentes e mostram muito pouco contraste interno e com o ambiente ao redor.
A observação com o microscópio óptico simples do campo transparente, sem o uso de técnicas de coloração auxiliar, é muito limitado e é usado apenas em alguns casos, como na observação do movimento do microorganismo.
Para a observação de microorganismos de maneira ideal, é necessário alcançar um equilíbrio entre o contraste e a resolução. Os detalhes das células não podem ser observados no microscópio, mesmo com alta resolução; É necessário o uso de corantes através de técnicas de coloração, que contribuem para a observação.
Características de uma mancha bacteriana de boa qualidade
Excelente contraste
Para alcançar um excelente contraste, existem microscópios sofisticados chamados Microscópio de contraste de fase, interferência diferencial e microscópio de campo escuro. Esse tipo de microscópio é usado para observar estruturas bacterianas, como vagens e filamentos, entre outros.
A coloração é uma técnica simples para aumentar o contraste que é alcançado com um microscópio de campo claro. Nesta técnica, diferentes corantes podem ser usados que melhoram significativamente a observação do microscópio.
A coloração é feita diretamente nos manchas ou extensões das suspensões de microorganismos nos slides, anteriormente secos e fixos.
Bom fixo
A fixação é uma técnica usada para preservar estruturas celulares; causa inativação de microorganismos e adesão ao vidro do slide. Existem diferentes tratamentos de fixação: fixação de calor e fixação química.
Pode atendê -lo: ácido palmitoleico: estrutura, funções, onde estáFixação de calor
Este é o método mais usado na observação de mancha bacteriana. A técnica consiste em passar a suspensão bacteriana de esfregaço pela chama de um isqueiro. Esta técnica é capaz de preservar a morfologia externa das bactérias, mas destrói suas estruturas internas.
Fixação química
A fixação química usa substâncias químicas na preservação, como formaldeído ou formalina, etanol e ácido acético, entre outros. A vantagem de usar agentes químicos de fixação é que a preservação das estruturas celulares internas dos microorganismos é alcançada.
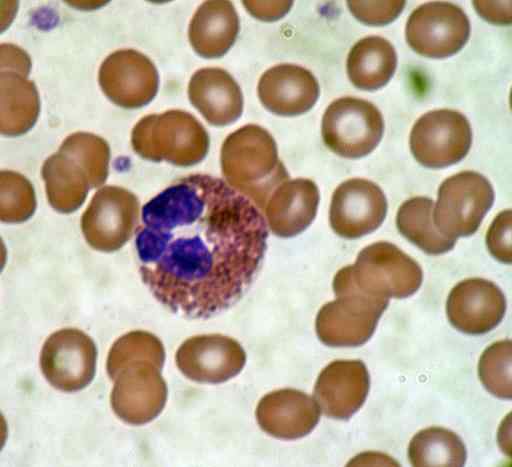
 Mancha de sangue. Fonte: Bobjgalindo [GFDL (http: // www.gnu.Org/copyleft/fdl.html) ou CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons
Mancha de sangue. Fonte: Bobjgalindo [GFDL (http: // www.gnu.Org/copyleft/fdl.html) ou CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons Boa coloração
Os procedimentos mais comuns para realizar a coloração de um esfregaço fixo anterior e fixo são a coloração positiva ou simples, a coloração diferencial e a coloração negativa. Também existem técnicas especiais para manchar estruturas celulares específicas (cápsula, esporos, flagelos).
Coloração positiva ou coloração simples
A coloração positiva ou simples é a técnica de mancha de mancha mais usada. Use corantes que têm a capacidade de ingressar em determinadas estruturas microbianas, permitindo que elas os observem no microscópio.
Esses corantes têm grupos cromóficos (porção colorida) em sua estrutura química, com ligações duplas alternativas e ligações simples (conjugação). Esses links podem, por sua vez, estabelecer ligações iônicas ou covalentes com algumas estruturas celulares.
Os corantes usados na coloração positiva ou simples são principalmente derivados químicos do anilina (sais orgânicos coloridos).
Por outro lado, entre os corantes, podemos encontrar alguns com pH básico e outros com pH ácido.
Corantes básicos
Nos corantes básicos, o grupo cromóforo tem uma carga elétrica positiva. A grande maioria dos microorganismos procarióticos tem um pH neutro interno, e sua superfície celular tem uma carga negativa. Através dessa interação eletrostática, o cromóforo está se ligando à célula e corante.
Exemplos de corantes básicos são azul de metileno, vidro violeta, verde malaquita, fusível básico, safranina, entre outros.
Corantes ácidos
Nos corantes ácidos, o grupo cromóforo tem uma carga elétrica negativa. Estes são usados para coloração de proteínas com grupos de carga positiva. Exemplos de corantes ácidos são fusíveis ácidos, rosa de Bengala, Red Congo e eosin.
Pode atendê -lo: Propagem: O que é, tipos e suas característicasColoração diferencial
A técnica de coloração diferencial é aplicar dois corantes de cor ou intensidade diferentes, para distinguir o microscópio microscópio. Coloração de grama e coloração com resistência ao álcool ácido são a coloração diferencial mais usada na bacteriologia.
A coloração de Gram é usada como um teste preliminar para conhecer a forma, tamanho, grupo de células, além do tipo de parede celular. Por teste de coloração de grama, as bactérias da parede celular são classificadas como bactérias gram -positivas e bactérias gram -negativas.
Coloração negativa
Nesta técnica, são usados corantes químicos que não penetram no interior celular, mas fazem o meio no qual os microorganismos são aparecem como um fundo preto.
Na técnica de coloração negativa, a mancha é preparada com uma gota de suspensão de tinta chinesa ou nigrosina, que depois de permitir a secagem à temperatura ambiente forma um filme opaco para a passagem da luz. Dessa maneira, os microorganismos são observados como formas brilhantes em um fundo escuro.
Preparação
PARA. Mancha
1.- Lave muito bem os slides, seque com papel absorvente e rotule -os. O rótulo deve indicar conteúdo da preparação, data e nome daqueles que o processaram.
2.- Acender o isqueiro e esterilizar a alça de inoculação na chama para o vermelho vivo.
3.- Deixe a alça.
4.- Pegue o tubo da colheita bacteriana, remova a tampa e passe rapidamente a boca do tubo perto da chama mais clara (chama).
5.- Digite a alça de inoculação no tubo que contém a cultura bacteriana e pegue a amostra.
6.- Se a colheita estiver em líquido, coloque a amostra coletada com a alça no centro da lâmina e estenda -a cuidadosamente em um círculo de aproximadamente 2 cm de diâmetro.
7.- Esterilizar a alça de inoculação.
8.- Deixe a secagem da mancha no ar.
9.- Repita as etapas de 3 a 8 três vezes.
10.- Se a colheita estiver em sólido, uma gota de água destilada deve ser colocada anteriormente no slide. Isso é feito para misturar uma pequena amostra da colheita realizada com a alça de inoculação, de acordo com as indicações das etapas 2 a 5 (condições da Asepsis).
Pode atendê -lo: Biologia de Desenvolvimento: História, que estudos, aplicaçõesonze.- Estenda a amostra diluída com a gota de água no slide e repita três vezes.
B. Fixação
1.- Adicione aos professores de mancha seca -Crop em meio líquido -duas gotas de metanol ou etanol absoluto.
2.- Deixe o ar secar do isqueiro.
3.- Se o mancha vier de uma cultura sólida, o cheiro fixo é feito com calor, passando 2 a 3 vezes rápido.
4.- Toque na parte inferior do mancha com a parte dorsal da mão esquerda (para a direita -com a direita; caso contrário, use a mão direita) e verifique se está frio.
C. Coloração simples
1.- Adicione à mancha 2 gotas do corante selecionado e deixe agir pelo tempo necessário nos protocolos específicos de cada corante (geralmente entre 1 e 5 minutos).
2.- Alguns corantes requerem uso de calor para ativação; nesse caso, você deve ter muito cuidado ao aquecer a bagagem na chama do isqueiro (manipulando -a com uma pinça e evitando ferver). Um superaquecimento do mancha pode destruir as células desejadas.
3.- Remova o excesso de lavagem de corante com água destilada de uma imagem. Elimine a água de lavagem, atingindo suavemente o slide para sua música, inclinada na mesa de trabalho.
4.- Deixe a secagem do ar.
5.- Dependendo do tipo de observação, uma capa é usada ou não nesta fase. A cobertura e preserva a mancha. Se uma observação de mergulho de petróleo for realizada nesta fase, o esfregaço não é usado, mas o esfregaço não pode ser preservado.
D. Preservação definitiva de mancha
1.- Submergir o mancha sucessivamente em cada uma das soluções indicadas abaixo, por um mínimo de 5 minutos. O objetivo desses "banheiros" é deixar o mancha completamente desidratado. Cada reagente deve ser drenado bem, antes de entrar na mancha no banheiro seguinte.
A ordem dos banhos desidratados é a seguinte:
- 70 % de etanol
- 95 % de etanol
- Acetona pura
- Mistura de acetona -xilol 1: 1
- Xilol
Em seguida, deixe a secagem do ar.
2.- Monte as tampas, de preferência 22 × 22 mm, usando o bálsamo do Canadá ou outros meios para montagem.
Referências
- Cappucino, j.G. e Welch, C.T. (2017). Microbiologia: um laboratório manual. Pearson.
- Holt, j.G. editor. (1977). O manual de bacteriologia determinante de Bergey mais curta. 8º Baltimore: The Williams e Wilkins Co.
- « O que é dissulfúrico o que é, estrutura, propriedades, usa
- O que é o aparelho psíquico de Sigmund Freud? »

