Características e efeitos da carboxihemoglobina
- 4612
- 1270
- Lonnie MacGyver
O carboxihemoglobina É hemoglobina ligada ao monóxido de carbono (CO). A hemoglobina é a proteína que transporta oxigênio através do sangue para humanos e em muitos outros vertebrados.
Para transportar oxigênio, a hemoglobina deve se juntar a isso. Max Perutz, um prêmio de química e Nobel nascido em Viena em 1914 e morto em Cam-Bridge em 2002, chamado "Hemoglobin Oxygen Ligning Behavior".
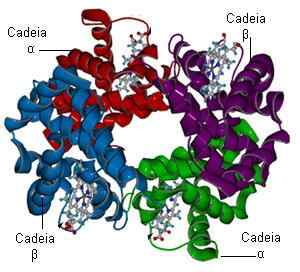
 Estrutura de hemoglobina (Fonte: Bielabio via Wikimedia Commons)
Estrutura de hemoglobina (Fonte: Bielabio via Wikimedia Commons) Imagine duas moléculas de hemoglobina capazes de se juntar a cada uma a quatro moléculas de oxigênio. Um já tem três moléculas de oxigênio e o outro nenhum. Se outra molécula de oxigênio aparece, a questão é a seguinte: ela se liga ao "rico" que já tem três, ou o "pobre" que não tem não? A probabilidade é de 100 a 1 de que a molécula rica é direcionada.
Imagine agora duas outras moléculas de hemoglobina. Um tem 4 moléculas de oxigênio (está saturado) e o outro só tem um. Qual das moléculas é a mais provável de dar oxigênio aos tecidos, os ricos ou os pobres? Os mais pobres entregarão mais facilmente oxigênio do que ricos.
A distribuição de oxigênio na molécula de hemoglobina pode ser vista como a parábola bíblica: "... quem tem, que será dado e quem não possui, mesmo o que ela terá será removido ..." (Mt, 13:12 ). Do ponto de vista fisiológico, esse comportamento "imoral" da molécula de hemoglobina está cheio de significado, a posição contribui para a contribuição do oxigênio para os tecidos.
Monóxido de carbono, no entanto, qualquer que seja o número de átomos de oxigênio se uniram a uma molécula de hemoglobina, "varre" com todos. Isto é, na presença de abundante CO, todo oxigênio ligado à hemoglobina é substituído por CO.
[TOC]
Características estruturais
Para falar sobre carboxihemoglobina, que nada mais é do que um estado de hemoglobina associado ao monóxido de carbono, é necessário primeiro se referir à hemoglobina em termos gerais.
A hemoglobina é uma proteína composta por quatro subunidades formadas por uma cadeia polipeptídica conhecida como globina e um grupo natural não -proteína (grupo protético) chamado Hemo.
Pode servir a você: Bioestadistics: História, Campo de Estudo e AplicaçõesCada grupo Hemo contém um átomo de ferro no estado ferroso (fé2+). Estes são os átomos capazes de unir oxigênio sem oxidar.
O tetrâmero de hemoglobina é constituído por duas subunidades de alfa globina, 141 aminoácidos cada e duas subunidades de beta globina, 146 aminoácidos cada.
Formas ou estruturas de hemoglobina
Quando a hemoglobina não está ligada a nenhum átomo de oxigênio, a estrutura da hemoglobina é rígida ou tensa, produto da formação de pontes salinas dentro.
A estrutura quaternária da hemoglobina sem oxigênio (desoxigenada) é conhecida como estrutura "t" ou tensa, e a hemoglobina oxigenada (oxihemoglobina) é conhecida como "r" ou estrutura relaxada.
A transição da estrutura t para a estrutura r ocorre por meio da união de oxigênio para o átomo de ferro ferroso (fé2+) do grupo Hemo ligado a cada cadeia globina.
Comportamento cooperativo
As subunidades que compõem a estrutura da hemoglobina mostram comportamento cooperativo que pode ser explicado com o exemplo a seguir.
Você pode imaginar a molécula de hemoglobina desoxigenada (na estrutura t) como uma concha de lã com os locais de ligação de oxigênio muito ocultos (grupos de bainha) dentro dela.
Quando essa estrutura tensa se junta a uma molécula de oxigênio, a velocidade da união é muito lenta, mas essa união é suficiente para soltar um pouco a bola e trazer o seguinte grupo Hemo para a superfície, fazendo a velocidade com que liga o seguinte oxigênio é maior, repetindo o processo e aumentando a afinidade com cada união.
Efeitos de monóxido de carbono
Para estudar os efeitos do monóxido de carbono no transporte sanguíneo de gases, é necessário primeiro.
Pode atendê -lo: Briologia: o que é, história, que estudosA curva de oxihemoglobina tem uma forma sigmóide ou "s" que varia dependendo da pressão parcial do oxigênio. O gráfico de curvas está claro nas análises feitas para as amostras de sangue usadas para construí -lo.
A região mais inclinada da curva é obtida com pressões abaixo de 60 mmHg e a pressões maiores que isso, a curva tende a achatar, como se atingisse um platô.
Quando na presença de certas substâncias, a curva pode mostrar desvios significativos. Esses desvios mostram mudanças que ocorrem na afinidade da hemoglobina devido a oxigênio ao mesmo2.
Para quantificar esse fenômeno, foi introduzida a medida da afinidade da hemoglobina por oxigênio, conhecida como Valor Pcinquenta, que é o valor parcial da pressão de oxigênio para o qual a hemoglobina é 50% saturada; isto é, quando metade de seus grupos Hemo está unida a uma molécula de oxigênio.
Em condições padrão, que devem ser entendidas como pH 7.4, Parcial 40 mmHg de pressão de oxigênio e temperatura de 37 ° C, p, pcinquenta Sob um homem adulto é de 27 mm Hg ou 3,6 kPa.
Quais fatores podem afetar a afinidade da hemoglobina por oxigênio?
A afinidade pelo oxigênio da hemoglobina contida nos eritrócitos pode diminuir na presença de 2,3 defosfoglicerato (2-3dpg), de dióxido de carbono (CO2), de altas concentrações de prótons ou por aumento da temperatura; E o mesmo vale para o monóxido de carbono (CO).
Implicações funcionais
O monóxido de carbono é capaz de interferir na função de transporte de oxigênio no sangue arterial. Esta molécula é capaz de se juntar à hemoglobina e formar carboxihemoglobina. Isso ocorre porque tem uma afinidade pela hemoglobina cerca de 250 vezes maior que o O2, Então ele é capaz de movê -lo mesmo quando está ligado a ela.
Pode atendê -lo: Agar Czapek: Fundação, Preparação, Usos e LimitaçõesO corpo produz monóxido de carbono permanentemente, embora em pequenas quantidades. Este gás, incolor e banheiro, se junta ao grupo Hemo da mesma maneira que ele2, E normalmente existem cerca de 1% da hemoglobina sanguínea, como a carboxihemoglobina.
Como a combustão incompleta da matéria orgânica produz CO, a proporção de carboxihemoglobina em fumantes é muito maior, sendo capaz de atingir valores entre 5 e 15% da hemoglobina total. O aumento crônico na concentração de carboxihemoglobina é prejudicial à saúde.
Um aumento na quantidade de CO que é inspirada que gera mais de 40% de carboxihemoglobina ameaça a vida. Quando o local ferroso de ligação de ferro é ocupado por um CO, você não pode acertar o O2.
A união de CO produz a transição da hemoglobina para a estrutura r, de modo que a hemoglobina reduz ainda mais a capacidade de entregar ou2 Em capilares sanguíneos.
Carboxyhemoglobin tem uma cor vermelha clara. Portanto, os pacientes envenenados com CO adotam uma cor rosa, mesmo em coma e condição de paralisia respiratória. O melhor tratamento para tentar salvar a vida desses pacientes é fazer inspiração pura e até hiperbárica de oxigênio, para tentar deslocar a união de ferro com CO.
Referências
- Fox, s. Yo. (2006). Fisiologia humana 9ª edição (pp. 501-502). McGraw-Hill Press, Nova York, EUA.
- Murray, r. K., Granner, d. K., Mayes, p. PARA., & Rodwell, V. C. (2014). Bioquímica ilustrada de Harper. McGraw-Hill.
- Rawn, j. D. (1998). Bioquímica (1989). Burlington, Carolina do Norte: Neil Patterson Publishers (C) N. Lalioti, CP Raptopoulou, um. Terzis, a. Panagiotopoulos, sp perlepes e. Manessi-Zouopa, J. Chem. Soc. Dalton Trans, 1327.
- Robert m. Berne, Matthew N. Imposição. (2001) Fisiologia. (3ª ed.) Harcourt Editions, S.PARA.
- West, J. B. (1991). Base fisiológica da prática médica. Williams & Wilkins
- « Características de avaliação qualitativa, vantagens, exemplos
- Teoria da aprendizagem observacional, características, exemplos »

