Estrutura, propriedades e usos de Bromuro (AGBR) de prata (AGBR)
- 3243
- 916
- Dennis Heidenreich
Ele Brometo de prata É um sal inorgânico cuja fórmula química é AGBR. Seu sólido consiste em cátio+ E Br Aniss- em uma proporção 1: 1, atraída por forças eletrostáticas ou por links iônicos. Pode ser visto como se o metal prateado tivesse dado um de seus elétrons de valência ao bromo molecular.
Sua natureza se assemelha a seu "irmãos" cloreto e prata yoduro. Os três sais são insolúveis em água, eles têm cores semelhantes e, além disso, são sensíveis à luz; isto é, eles sofrem reações fotoquímicas. Esta propriedade foi usada na obtenção de fotografias, o resultado da redução de íons Ag+ para metal prata.
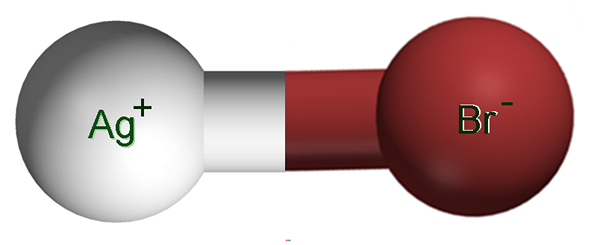
 Íons de brometo de prata. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Íons de brometo de prata. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Na imagem superior, um par iônico age é mostrado+Br-, em que as esferas brancas e marrons correspondem aos íons Ag+ e br-, respectivamente. Aqui eles representam o vínculo iônico como AG-BR, mas é necessário indicar que não existe um vínculo covalente entre os dois íons.
Pode parecer contraditório que a prata seja quem fornece a cor preta das fotografias incolores. Isso ocorre porque o AGBR reage com a luz, gerando uma imagem latente; que, então se intensifica aumentando a redução de prata.
[TOC]
Estrutura de brometo de prata
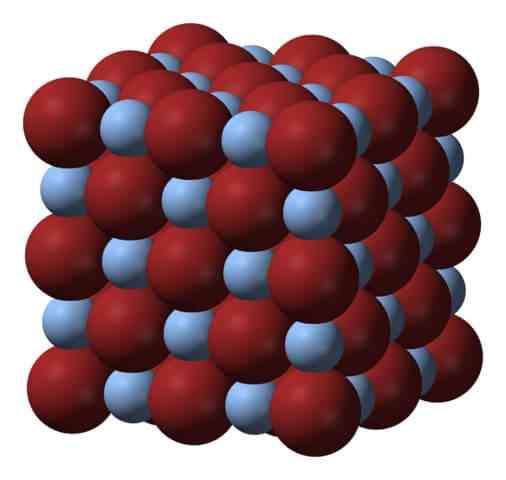 Estrutura cristalina de brometo de prata. Fonte: Benjah-BMM27 via Wikipedia.
Estrutura cristalina de brometo de prata. Fonte: Benjah-BMM27 via Wikipedia. Acima da rede ou estrutura cristalina do brometo de prata. Aqui é mostrada uma representação mais fiel da diferença de tamanho entre os rádios iônicos de AG+ e br-. Ânions BR-, Mais volumoso, deixe interstices onde os cátions aglomeralmente estão localizados+, que é cercado por seis BR- (e vice-versa).
Essa estrutura é característica de um sistema cristalino cúbico, especificamente do tipo de sal; o mesmo, por exemplo, que para cloreto de sódio, NaCl. De fato, a imagem facilita isso tendo um limite cúbico perfeito.
Pode servir a você: Referência Eletrodo: Características, Função, ExemplosÀ primeira vista, pode -se notar que há alguma diferença de tamanho entre íons. Isso, e talvez as características eletrônicas do AG+ (e do possível efeito de algumas impurezas), leva a cristais AGBR que apresentam defeitos; isto é, sites onde a sequência de pedidos de íons no espaço é "quebra".
Defeitos cristalinos
Esses defeitos consistem em lacunas deixadas por íons ausentes ou deslocados do lugar. Por exemplo, entre seis ânions BR- Normalmente deve ser o Crutor AG+; Mas, em vez disso, pode haver um vácuo porque a prata se mudou para outro interstício (defeito de Frenkel).
Embora afetem a rede cristalina, eles favorecem as reações de prata com luz; E quanto maior os cristais ou seu cluster (tamanho do grão), maior o número de defeitos e, portanto, será mais sensível à luz. Da mesma forma, as impurezas influenciam a estrutura e essa propriedade, especialmente aquelas que podem ser reduzidas com elétrons.
Como conseqüência deste último, os grandes cristais da AGBR requerem menor exposição à luz para reduzir; isto é, eles são mais desejáveis para fins fotográficos.
Síntese
No laboratório, você pode sintetizar o brometo de prata misturando uma solução aquosa de nitrato de prata, Agno3, Com sal de brometo de sódio, Nabab. O primeiro sal traz prata e o segundo brometo. O que se segue é uma reação de deslocamento duplo ou metátese que pode ser representado com a equação química abaixo:
Agno3(aq) + nabab (s) => nano3(aq) + AGBR (s)
Pode atendê -lo: brometo de sódio (NABR)Observe que o sal de nitrato de sal, nano3, É solúvel em água, enquanto o AGBR precipita como um sólido com uma cor amarela fraca. Posteriormente, o sólido é lavado e passa a vácuo. Além do NABB, a KBR também pode ser usada como fonte de ânions bromurosos.
Por outro.
Propriedades
Aparência
Amarelo de argila sólido semelhante a uma argila.
Massa molecular
187,77 g/mol.
Densidade
6.473 g/ml.
Ponto de fusão
432 ° C.
Ponto de ebulição
1502 ° C.
Solubilidade em água
0,140 g/ml a 20 ° C.
Índice de refração
2.253.
Capacidade de calor
270 j/kg · k.
Sensibilidade à luz
Dizia -se na seção anterior que, nos cristais AGBR, existem defeitos que promovem a sensibilidade desse sal na luz, uma vez que capturam os elétrons formados; E assim, em teoria, eles os impedem de reagir com outras espécies no meio, como oxigênio do ar.
O elétron é liberado da reação do BR- Com um fóton:
Br- + Hv => 1/2br2 + e-
Observe que existe um2, que tingirá o vermelho sólido se não for removido. Os elétrons liberados reduzem os cátions AGS+, Em seus interstícios, prata metálica (às vezes representada como AG0):
AG+ + e- => Ag
Então, tendo a equação líquida:
AGBR => Ag + 1/2br2
Quando as "primeiras camadas" de metal prata na superfície são formadas, diz -se que há uma imagem latente, ainda invisível para o olho humano. Esta imagem é tornada milhões de vezes mais visível se outra espécie química (como hidroquinona e fenidona, no processo de desenvolvimento) aumentar a redução de cristais AGBR em prata metálica de prata
Pode atendê -lo: Carbono 12: Notação nuclear, história, comentáriosFormulários
 Fotografia de relógio de bolso preto e branco. Fonte: pexels.
Fotografia de relógio de bolso preto e branco. Fonte: pexels. O brometo de prata é o mais usado de todos os seus halogenetos no campo de revelação de filmes fotográficos. O AGBR é aplicado a esses filmes, feito com acetato de celulose, suspenso em uma geléia (emulsão fotográfica) e na presença de sulfato de fenol (metilação) (metol) ou fenidona e hidroquinona.
Com todos esses reagentes, a vida pode ser dada à imagem latente; Acabar e acelerar a transformação de prata iônica em metal. Mas, se você não prosseguir com certos cuidados e experiência, toda a prata da superfície oxidará, e o contraste entre as cores preto e branco terminará.
É por isso que eles são vitais nos banheiros de desemprego, fixação e lavagem, de filmes fotográficos.
Existem artistas que brincam com esses processos de tal maneira que criam nuances cinzentas, que enriquecem a beleza da imagem e seu próprio legado; E tudo isso faz, às vezes talvez sem suspeitar, graças a reações químicas, cuja base teórica pode se tornar um pouco complexa e um AGBR sensível à luz e isso marca um ponto de partida.
Referências
- Wikipedia. (2019). Brometo de prata. Recuperado de: em.Wikipedia.org
- Michael w. Davidson . (13 de novembro de 2015). Galeria de imagens digitais de luz polarizada: brometo de prata. Olimpo. Recuperado de: micro.Magnético.Fsu.Edu
- CRYSTRAN LTD. (2012). Brometo de prata (AGBR). Recuperado de: crystran.co.Reino Unido
- Lothar Duenkel, Juergen Eichler, Gerhard Ackermann e Claudia Schneeweiss. (29 de junho de 2004). Emulsões baseadas em bromida de prata feitas por si mesmos para usuários em holografia: fabricação, processamento e aplicação, Proc. SPIE 5290, Holografia prática XVIII: Materiais e Aplicações; Doi: 10.1117/12.525035; https: // doi.org/10.1117/12.525035
- Alan G. Forma. (1993). Química Inorgânica. (Segunda edição.). Editorial revertido.
- Carlos Güido e Ma Eugenia Bautista. (2018). Introdução à química fotográfica. Recuperado de: fotografia.Ceduc.com.mx
- Garcia d. Lindo. (9 de janeiro de 2014). Química, fotografia e química Madoz. Recuperado de: dimetilsulfuro.é
- « Como educar uma criança adequadamente 13 conselhos práticos
- Estrutura do ciclobutano, propriedades, usos e síntese »

