História do Borax, estrutura, propriedades, usos, síntese, riscos

- 2638
- 817
- Ernesto Bruen
Ele Bórax ou borato de sódio É uma denominação para um grupo de compostos químicos com uma fórmula básica de NA2B4QUALQUER7. É um sal higroscópico capaz de formar numerosos hidratos, além de se enriquecer estruturalmente pela presença de certas impurezas de metal.
Os principais compostos chamados Borax são os seguintes: Anhidro2B4QUALQUER7; Tetraborato de sódio penta -hidrato (NA2B4QUALQUER7).5h2QUALQUER; e tetraborato de sódio, na2B4QUALQUER7.10h2Ou, ou seu equivalente, o tetraborato octa -hidrato de sódio, na2B4QUALQUER5(OH)4.8h2QUALQUER.
 Fragmento de Borax. Fonte: Leon Hupperichs [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Fragmento de Borax. Fonte: Leon Hupperichs [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] Como pode ser visto, todos os sólidos anteriores diferem apenas em seu grau de hidratação; Alguns têm mais moléculas de água em seus cristais do que outros. O bórax fisicamente é semelhante a peças ou cristais robustos de giz (imagem superior).
Naturalmente, o Borax é encontrado em sedimentos de lagos sazonais, secos por evaporação. Borax ocorre na Turquia, Searles Lakes (Califórnia), no deserto Atacama, Chile, Bolívia, Tibete e Romênia. Sinteticamente, os cristais de bórax podem ser obtidos através de um processo de nucleação lenta; isto é, aquele em que o crescimento dos cristais é favorecido.
O tetraborato anidro, anidro e decadrado é pouco solúvel em água fria; Mas sua solubilidade aumenta com um aumento de temperatura. Então uma2B4QUALQUER7.10h2Ou é muito solúvel em etileno glicol, moderadamente solúvel em etanol e pouco solúvel em acetona; Estes são menos solventes polares que a água.
O Borax possui inúmeras aplicações, como na elaboração de detergentes e sabonetes; como um atraso do fogo do material celulósico; na produção de fibra de vidro; na limpeza de superfícies duras, como metais, vidro e cerâmica; e na inibição de corrosão, entre outros usos.
O bórax é irritante para olhos, pele e trato respiratório. Por ingestão, ele pode produzir, entre outros sintomas, vômitos, diarréia, flacidez, decaimento e convulsões. Atualmente suspeita -se que efeitos nocivos na reprodução humana possam ter.
[TOC]
História
A história do Borax é confusa. É apontado que foi descoberto na cama de um lago Tibete, seco por evaporação. Foi transferido no século VII do Tibete para a Arábia Saudita, seguindo a rota de seda de So So -.
O termo "Borax" era popular após as inúmeras aplicações encontradas e comercializadas com o nome de 20 mule borax tradermax, que se referiu à maneira como o Borax foi transportado pelos desertos de Nevada e Califórnia.
Outra versão de sua descoberta indica que os egípcios conheciam por sua existência há muito tempo, usando -a nas soldas de metais pelo calor. Além disso, eles o usaram na medicina e no processo de mumificação. Borax foi transferido para a Europa no século XIII por Marco Polo.
Em meados do século XIX, grandes depósitos de bórax foram descobertos no deserto de Magove, o que tornou seu uso comum desde então.
Estrutura de bórax
 Estrutura de íons borax. Fonte: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Estrutura de íons borax. Fonte: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] A imagem superior mostra os íons que compõem o bórax, correspondendo especificamente a um sólido com uma fórmula de composição de Na2[B4QUALQUER5(OH)4] · 8h2Ou (ou NA2B4QUALQUER7· 10h2QUALQUER).
Primeiro, a estrutura enjaulada do ânion pode ser notada [b4QUALQUER5(OH)4]2- (Embora eu deva ter dois grupos-), em que um anel octogonal (quatro átomos de B e quatro de O) pode ser visto), com uma ponte B-O-B dividindo-a em duas metades.
Pode atendê -lo: soluções alcalinas: definição, propriedades e usosEssa gaiola não permanece estática, mas vibra e adota diferentes conformações no espaço; No entanto, em menor grau nas proximidades da ponte. Também se pode notar que é muito "oxigenado"; Ou seja, possui muitos átomos de oxigênio, capazes de interagir com moléculas de água usando pontes de hidrogênio.
Não é de surpreender que os cristais de Borax possam hidratar e gerar numerosos hidratos. Assim, para o NA sólido2[B4QUALQUER5(OH)4] · 8h2Ou, existem oito moléculas H2Ou interagir com a gaiola de borarato e, ao mesmo tempo, com os centros de metal de Na+.
No lado do cátio, você tem o complexo aquoso [Na (h2QUALQUER)4]+n, onde o valor de n dependerá da proporção ânion/cátion. No sólido superior, n = 2, então você tem: [na2(H2QUALQUER)8]2+, cuja carga 2+ neutraliza a carga 2- do ânion de borarato.
Cristais
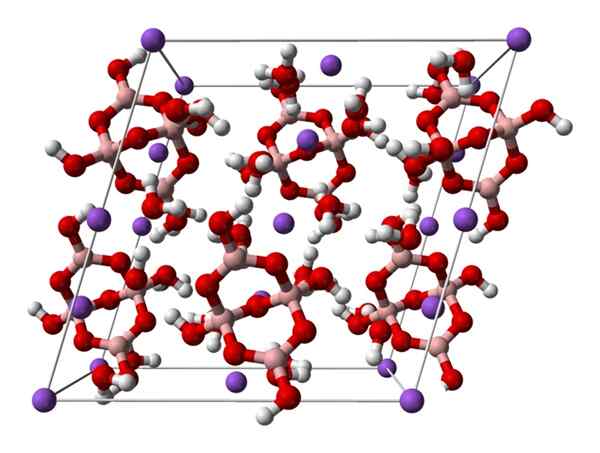 Célula monoclínica de Borax. Fonte: Ben Mills [público
Célula monoclínica de Borax. Fonte: Ben Mills [públicoDomínio].
Acima2[B4QUALQUER5(OH)4] · 8h2Ou ou na2B4QUALQUER7· 10h2QUALQUER. Aqui, atrações eletrostáticas e pontes de hidrogênio governam ou dominam os padrões estruturais originados em cada vidro do vidro.
Outros hidratos e sal anidro perdem uma ou todas as suas moléculas de água, alterando a composição e a estrutura do cristal de Borax. Em todos eles, ânion e cátion permanecem os mesmos (a menos que haja impurezas ou reações laterais), portanto a confusão não pode ser gerada.
Confusões com o ânion Boraato
N / D2[B4QUALQUER5(OH)4] · 8h2Ou e na2B4QUALQUER7· 10h2Ou eles são iguais. Porque?
Primeiro, se seus átomos forem contados, eles verão que coincidem em número; E em segundo lugar, no ânion B4QUALQUER72- A ausência dos dois grupos OH ligados às cabeças de boro das pontes B-O-B é considerada; dois oh isso, juntamente com os dois H+ de b4QUALQUER72-, adicione até 2 h2Ou, dando um total de 10 h2O (8 + 2).
Propriedades
Nomes
- Bórax.
- Borarato de sódio.
- Tetraborato de sódio.
- Tetraborato dativo.
Massa molecular
Anhydro: 201,22 g/mol.
Decohydrate: 381,38 g/mol.
Aparência física
Um sólido branco cristalino.
Densidade
Anidro: 2,4 g/cm3
Decahixture: 1.739 g/cm3
Ponto de fusão
Anhidro: 743 ºC (1.369 ºF, 1.016 K).
Decohidrato: 75 ºC.
Ponto de ebulição
Anhidro: 1.575 ºC (2.867 ºf, 1.848 K).
Solubilidade em água
31,78 g/L (ambos para anidro e decapiário).
Solubilidade em solventes orgânicos
É muito solúvel em etileno glicol, moderadamente solúvel em dietileno glicol e metanol e ligeiramente solúvel em acetona.
Índice de refração (ηd)
Anhidro: η1 = 1.447; η2 = 1.469.
Decayedrado: η2 = 1.472.
Estabilidade
É estável sob condições de armazenamento adequadas. Embora tenha uma baixa pressão de vapor, aumenta com a temperatura, causando cristalização e condensação, portanto, a temperatura excessiva e as flutuações de umidade devem ser evitadas.
Emissão de luz
O tetraborato de sódio quando submetido à ação do fogo emite uma luz verde.
Reações
- Ao se dissolver na água, as soluções alcalinas se originam com um pH em torno de 9,2.
- O Borax reage para formar outros boratos, como o perborato (PBS).
- Também produz ácido bórico ao reagir com ácido clorídrico:
N / D2B4QUALQUER7· 10h2O + hcl => 4 h3Bo3 + 2 NA+ + 2 Cl- + 5 h2QUALQUER
- O tetraborato de sódio se comporta como uma substância de anfóis, pois em solução aquosa é hidrolisada e é capaz de neutralizar o ácido. Da mesma maneira, é capaz de neutralizar alcalis de alta concentração, evitando elevação excessiva do pH médio.
Pode atendê -lo: álcool primário: estrutura, propriedades, nomenclatura, exemplosFormulários
Borax tem inúmeras aplicações, tanto no ser humano quanto no conjunto de atividades que ele executa.
Ação antioxidante
O Borax tem a capacidade de dissolver óxidos. Por esse motivo, é usado na recuperação de metais como latão, cobre, chumbo e zinco.
Também é usado para impedir a oxidação de barras de metal nas fundações. O Borax cobre sua superfície, excluindo o ar e, portanto, evitando a oxidação. Além disso, evita a corrosão do material ferroso na fabricação de carros.
A solubilidade do bórax em etileno glicol tem sido útil em formulações anticongelantes. O bórax neutraliza os resíduos ácidos que são produzidos durante a decomposição do etileno glicol, minimizando a oxidação de que a superfície dos metais pode sofrer.
Elaboração de adesivos
- O Borax faz parte de uma formulação de amido adesivo para papel e papelão ondulado.
- É um agente peptizante na fabricação de adesivos baseados em caseína e dextrina.
- Atos fortalecendo materiais adesivos cruzando os grupos hidroxilos conjugados.
Retardante de fogo
É usado como retardador de incêndio em materiais celulósicos e outros polímeros que contêm grupos hidroxilos. Ele exerce sua ação através de vários mecanismos, incluindo a formação de uma camada vítrea que limita o acesso de combustíveis.
Elaboração de vidro borosilizado (pyrex)
O Borax é uma fonte de boro usado na elaboração do vidro borossilizado; caracterizado por um alto ponto de fusão, baixo coeficiente de expansão e alta resistência a choques térmicos.
Isso permite que você esteja sujeito a altas temperaturas sem experimentar fraturas, recebendo a denominação refratária de vidro.
O vidro borossilizado é usado na elaboração de materiais a serem usados em casa para assar comida. Também é usado em laboratório em copo, fixolas, mede cilindros, pipetas, etc.
Emulsificante
O Borax, juntamente com outros compostos, é usado para emulsificar sabonetes e outras parafinas. Também é usado como base para a elaboração de loções, cremes e pomadas.
Limpando material
- É adicionado nas formulações para limpar superfícies firmes, como metais, vidro e cerâmica.
- É usado em produtos de limpeza de mão, material de polimento e sabonetes de detergente em lavanderias e casa. Além disso, facilita a remoção de depósitos oleosos dos pisos das fábricas.
Usos médicos
- É usado no tratamento de infecções por fungos de pés.
- Faz parte da fórmula de nutrientes que fornece boro. Pensa -se que esse elemento intervenha no metabolismo de cálcio, fósforo e magnésio, sendo necessário para a estrutura óssea.
- Ele intervém na determinação da hemoglobina glicosilada (HbA1c), a prova que serve para conhecer o desenvolvimento de diabetes a longo prazo em um paciente, uma vez que o tempo de meia -vida de um eritrócito é de 120 dias.
Esta informação é mais útil para o médico do que as determinações isoladas da glicose no sangue do paciente.
Amortecedor de pH
É usado em vários amortecedores de pH usados na bioquímica; Entre eles, o Tris (hidroximetil) aminometano-boray, usado em eletroforese em poliacrilamida de DNA e ácidos nucleicos de RNA.
Diminuição da dureza da água
Borax é capaz de combinar com os íons de cálcio e magnésio presentes na água, diminuindo sua concentração. Dessa maneira, a dureza da água é reduzida.
Pode atendê -lo: hidróxido de potássio: estrutura, propriedades, usosFertilizante e fertilizante
O Borax é usado como fonte de boro. Cálcio e boro estão envolvidos na formação da parede celular das plantas. Além disso, foi apontado que o boro favorece a polinização, por isso intervém na fertilização e proliferação de plantas.
Conservação de madeira
Borax luta contra o Woodwood, um besouro que consome e destrói a madeira. Também é usado na conservação e manutenção de navios de madeira.
Fundador e fluxo
É usado como fundador em soldagem de aço e ferro, causando uma diminuição no ponto de fusão e na eliminação do óxido de ferro; Um poluente indesejável. Com um fim semelhante, ele participa da soldagem de ouro e prata.
Outros
- É usado como um pesticida macio; Por exemplo, para o combate de mariposas em lã.
- A pulverização serve para o controle de pragas presentes em armários, depósitos internos, nas lacunas das paredes e, em geral, onde o uso de mais pesticidas poluentes não é desejado.
- É usado em reatores nucleares para controlar as reações que podem produzir, em casos extremos, uma reação em cadeia.
- Nos radiadores de carros, o Borax é usado para obter os sites onde há escapadas de água.
Síntese
O Borax é obtido por React5QUALQUER9.8h2Ou, com carbonato de sódio e hidrocarbonato de sódio em meio aquoso.
Na verdade, a síntese de tetraborato de sódio ou bórax é pouco usada; A maior parte do composto produzido é obtido por sua extração dos minerais que o contêm.
O processo pode ser resumido em uma solução do minério na água, seguida por uma filtração de argila e finalmente uma evaporação da solução aquosa.
Riscos
O Borax é um produto natural, no entanto, pode produzir uma série de danos à saúde em humanos. Por exemplo, devido ao contato com a poeira, uma irritação da pele que pode causar dermatite pode ocorrer.
Da mesma forma, o bórax produz irritação dos olhos e o trato respiratório superior. Entre os sintomas de sua inalação, há dor de tosse e garganta.
Enquanto isso, a ingestão de bórax apresenta os seguintes sintomas: vômito, náusea, diarréia, flacidez, dor de cabeça e convulsões. Além disso, pode ocorrer uma afetação do sistema nervoso central e do funcionamento renal.
A partir de estudos realizados em ratos sexo masculino, alimentados com bórax, foi observada atrofia testicular. Enquanto os estudos realizados com ratos grávidas apontaram que o Borax poderia atravessar a placenta, produzindo uma alteração do desenvolvimento fetal, manifestado pelo baixo peso ao nascer.
Acredita -se que a exposição ao bórax possa afetar a função reprodutiva masculina no homem, manifestada por uma redução na contagem de espermatozóides.
Uma dose fatal de 10 a 25 gramas é estimada para a ingestão de bórax em adultos.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Centro Nacional de Informações sobre Biotecnologia. (2019). Argônio. Banco de dados PubChem. CID = 23968. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Karolyn Burns, Seneca Joseph, & dr. Ryan Baumbach. (s.F.). Síntese e propriedades de cristais de bórax e ligas intermetallinas. Recuperado de: NationalMaglab.org
- Wikipedia. (2019). Bórax. Recuperado de: em.Wikipedia.org
- Rio Tinto. (2019). Borax desidrato. 20 Team Borax. Recuperado de: borax.com
- Fletcher Jenna. (14 de janeiro de 2019). O Borax é seguro para usar? Recuperado de: MedicalNewStody.com
- « Estrutura de cloreto de cromo (CRCL3), propriedades, usos
- Características alimentares transgênicas, vantagens, exemplos, consequências »

