Estrutura de cloreto de cromo (CRCL3), propriedades, usos

- 1626
- 406
- Terrence King IV
Ele Cloreto de cromo (CRCL3) É um sal inorgânico composto por críticas3+ e CLIONS- em uma proporção 1: 3; isto é, para cada CR3+ Existem três cl-. Como será visto mais tarde, suas interações não são iônicas. Este sal pode ocorrer de duas formas: Anhydra e Hexa -hidrato.
A forma anidro é caracterizada por apresentar uma coloração violeta-vermelha; Enquanto hexa -hidrato, CRCL3.6h2Ou, é verde escuro. A incorporação de moléculas de água modifica as propriedades físicas desses cristais; como seus pontos de ebulição e fusão, densidades, etc.
 Cristais Violet-River de cloreto de cromo (III) ANYDROS. Fonte: Ben Mills [domínio público]
Cristais Violet-River de cloreto de cromo (III) ANYDROS. Fonte: Ben Mills [domínio público] O cloreto de cromo (III) (de acordo com a nomenclatura de ações) se decompõe a altas temperaturas, tornando -se cloreto de cromo (II), CRCL2. É corrosivo para metais, embora seja usado no cromo: procedimento no qual os metais são cobertos com uma fina camada de cromo.
O cr3+, Vindo de seu respectivo cloreto, ele tem sido usado no tratamento do diabetes, especialmente em pacientes com nutrição parenteral total (TPN), que não ingerem a quantidade de cromo necessária. No entanto, os resultados são muito melhores (e mais confiáveis) se for fornecido como um picolinato.
[TOC]
Estrutura de cloreto de cromo
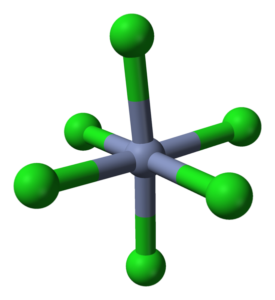 Coordenação OctaDro para CRCL3 em seus cristais. Fonte: Ben Mills [domínio público]
Coordenação OctaDro para CRCL3 em seus cristais. Fonte: Ben Mills [domínio público] O crcl3 Apesar de ser um sal, a natureza de suas interações não é puramente iônica; Eles têm um certo caráter covalente, produto da coordenação entre CR3+ e cl-, que dão origem a um octaedro deformado (imagem superior). O Chrome está localizado no centro do OctaDro e os Chloros em seus vértices.
O octaedro CRCL6 Você pode, à primeira vista, contradizer a fórmula CRCL3; No entanto, este octaedro completo não define a célula unitária do vidro, mas um cubo (também deformado), que corta as esferas verdes ou ânions de cloro ao meio.
Pode atendê -lo: 20 exemplos de sublimação química e característicasCamadas cristalinas de anidro
Assim, a célula unitária com este octaedro continua a manter a proporção 1: 3. Reproduzindo esses cubos deformados no espaço, o cristal CRCL é obtido3, que é representado na imagem superior com um modelo de enchimento tridimensional e um modelo de esferas e barras.
 Camada de estrutura cristalina CRCL3 representada com um modelo de esferas e barras tridimensionais. Fonte: Ben Mills [domínio público]
Camada de estrutura cristalina CRCL3 representada com um modelo de esferas e barras tridimensionais. Fonte: Ben Mills [domínio público] Esta camada cristalina é uma das muitas que fazem3 (Não confunda a cor do vidro, verdadeira, com a das esferas verdes).
Como pode ser visto, os ânions cl- Eles ocupam a superfície, então suas cargas negativas repelem as outras camadas cristalinas. Consequentemente, os cristais se tornam golpes e frágeis; Mas brilhante, por causa do cromo.
Se essas mesmas camadas forem visualizadas a partir de uma perspectiva lateral, será observada, em vez de octaedra, tetrahers distorcidos:
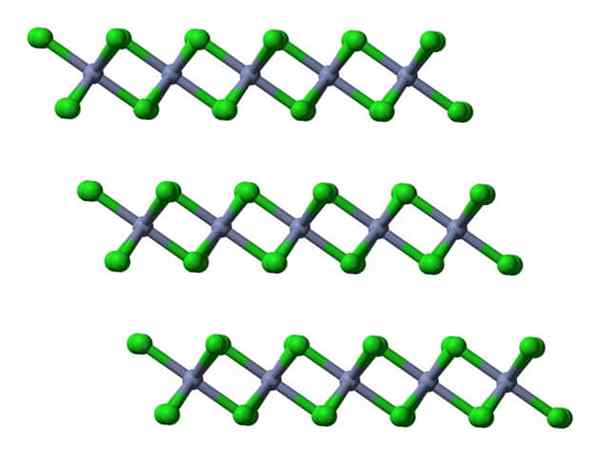 Visualizações de camadas cristalinas CRCL3. Fonte: Ben Mills.
Visualizações de camadas cristalinas CRCL3. Fonte: Ben Mills. Aqui, o entendimento de por que as camadas são repelidas entre si são facilitadas quando o CL- de suas superfícies.
Propriedades
Nomes
-Cloreto de cromo (iii)
-Tricloreto de cromo (iii)
-Cloreto de cromo (iii) anidro.
Fórmula química
-CRCL3 (anidro).
-CRCL3.6h2O (hexahing).
Peso molecular
-158,36 g/mol (anidro).
-266.43 g/mol (hexa -hidrato).
Descrição física
-Cristais sólidos e violeta-redísticos (anidrosos).
-Poeira cristalina verde escura (hexa -hidrato, imagem inferior). Neste hidrato, ele pode ser visto como a água inibe o brilho, o recurso de cromo de metal.
 Chrome Chrome hexa -hidrato. Fonte: Usuário: Walkerma [Domínio Público]
Chrome Chrome hexa -hidrato. Fonte: Usuário: Walkerma [Domínio Público] Ponto de fusão
-1.152 ºC (2.106 ºf, 1.425 K) (Anhidrum)
-83 ºC (hexa -hidrato).
Ponto de ebulição
1300 ºC (2.370 ºf, 1.570) (Anhidrum).
Solubilidade em água
 Soluções aquosas de cloreto de cromo (III). Fonte: LEIEM [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Soluções aquosas de cloreto de cromo (III). Fonte: LEIEM [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] -Ligeiramente solúvel (Anhydro).
-585 g/L (hexa -hidrato).
Na imagem superior, é mostrada uma série de tubos de teste preenchidos com uma solução aquosa de CRCL3. Observe que quanto mais concentrado, mais intensa a cor do complexo [Cr (oh2)6]3+, Cor verde responsável.
Pode servir a você: PULLRECINA: Estrutura, propriedades, síntese, usosSolubilidade em solventes orgânicos
Solúvel em etanol, mas insolúvel em éter (anidro).
Densidade
-2,87 gr/cm3 (anidro).
-2,76 g/cm3 (Hexa -hidrato).
Temperatura de armazenamento
Decomposição
Quando aquecido para decomposição, o cloreto de cromo (III) emite fumaça tóxica de compostos contendo cloro. Esses compostos também são liberados quando o cloreto de cromo (III) entra em contato com ácidos fortes.
Corrosão
É altamente corrosivo e pode atacar certos aços.
Reações
É incompatível com oxidantes fortes. Também reage fortemente com lítio e nitrogênio.
Quando é aquecido na presença de hidrogênio, é reduzido ao cloreto de cromo (II), com a formação de cloreto de hidrogênio.
2 crcl3 + H2 => 2 CRCL2 + 2 hcl
ph
Em uma solução aquosa, e com uma concentração de 0,2 m: 2,4.
Síntese
O cloreto de cromo (III) hexa -hidrato é produzido, reagindo hidróxido de cromo com ácido clorídrico e água.
Cr (oh)3 + 3 hcl +3 h2O => CRCL3.6h2QUALQUER
Então, para obter sal de Anhydra, o CRCL é aquecido3.6h2Ou na presença de cloreto de tionilo, socl2, Ácido clorídrico e calor:
[CR (H2QUALQUER)6] Cl3 + 6socl2 + ∆ → CRCL3 + 12 hcl + 6so2
Alternativamente, o CRCL3 O gás de cloro é obtido em uma mistura de cromo e óxido de carbono.
Cr2QUALQUER3 + 3 c +cl2 => 2 CRCL3 + 3 co
E, finalmente, sendo o método mais usado, é aquecer seu óxido com um agente halogenante, como o tetracloreto de carbono:
Cr2QUALQUER3 + 3ccl4 + ∆ → 2crcl3 + 3COCL2
Formulários
Industriais
O cloreto de cromo intervém na preparação no local do cloreto de cromo (II); Reagente que intervém na redução de halogenetos de alquil e na síntese de haluros de (e) -Salquenilo.
Pode atendê -lo: oxalato de sódio (Na2C2O4): estrutura, propriedades, usos, riscos-É usado na técnica cromada. Isso consiste em depositar, através da galvanoplastia, uma fina camada de cromo em objetos metálicos ou outro material com um objetivo decorativo, aumentando assim a resistência à corrosão e também a dureza da superfície.
-É usado como um mordente têxtil, servindo como um link entre o material de coloração e os tecidos a serem tingidos. Além disso, é usado como catalisador para a produção de olefinas e agentes de impermeabilização.
Terapêutica
O uso do suplemento de cloreto de cromo U USP é recomendado em pacientes que recebem apenas soluções intravenosas, administradas para nutrição parenteral total (TPN). Portanto, somente quando esses pacientes não recebem todos os seus requisitos nutricionais.
O cromo (III) faz parte do fator de tolerância à glicose, um ativador das reações promovidas pela insulina. Pensa -se que o cromo (III) ativa o metabolismo da glicose, proteínas e lipídios, facilitando a ação da insulina em humanos e animais.
O cromo está presente em vários alimentos. Mas sua concentração não excede 2 por ração, sendo o brócolis a comida com a maior contribuição (11 µg). Além disso, a absorção intestinal do cromo é baixa, com um valor de 0,4 a 2,5% da quantidade ingerida.
Isso dificulta o estabelecimento de uma dieta para o suprimento de cromo. Em 1989, a Academia Nacional de Ciências recomendou entre 50 e 200 µg/dia como uma ingestão adequada de cromo.
Riscos
Entre os possíveis riscos do consumo desse sal como um suplemento cromo, estão:
-Fortes dores de estômago.
-Sangramento anormal, que pode variar de dificuldades para curar uma ferida, hematomas vermelhos mais longos ou escurecimento do produto fezes fecais de sangramento interno.
-Irritações no sistema digestivo, causando úlceras estomacais ou intestinos.
-Dermatite
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Cloreto de cromo (III). Recuperado de: em.Wikipedia.org
- Cloreto de cromo (III) [PDF]. Recuperado de: alfa.Chem.Umb.Edu
- PubChem. (2019). Hexa -hidrato de cloreto de cromo. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Instituto Nacional de Saúde. (21 de setembro de 2018). Cromo: Folha de fato de suplementos dietéticos. Recuperado de: SDG.OD.NIH.Gov
- Tomlinson Carole a. (2019). Efeitos colaterais de cloreto de cromo. FOLE GRUPO LTD. Recuperado de: saudável.com
- « Por que é importante ler? 10 benefícios da leitura
- História do Borax, estrutura, propriedades, usos, síntese, riscos »

