Treinar ânion, características e tipos
- 4808
- 439
- Lonnie MacGyver
A ânion É todas as espécies químicas com carga negativa, além de ser um dos dois tipos de íons existentes. Sua carga negativa se origina do fato de apresentar um excesso de elétrons em comparação com a forma neutra da espécie; Para cada elétron adicional, sua carga negativa aumenta em uma unidade.
A carga negativa pode ser localizada em um ou mais átomos, além de cobrir sua influência em uma molécula em sua totalidade. A título de simplificação, independentemente de onde a carga está (-), ela é considerada um ânion para toda a espécie, composto ou molécula.
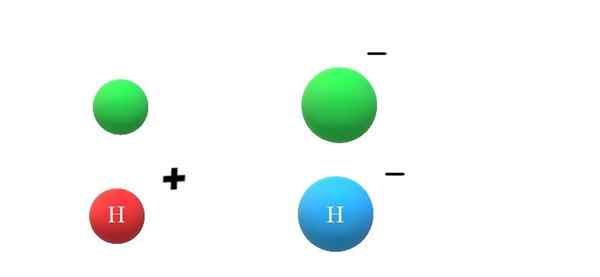
 Ânions. Fonte: Gabriel Bolívar.
Ânions. Fonte: Gabriel Bolívar. Se uma espécie neutra vencer um elétron, o excesso de cargas negativas se manifestará na formação de ânion x-, que também levará o aumento do seu raio atômico (imagem superior, com esferas verdes). X e x- Eles diferem muito em suas propriedades e na maneira como interagem com o ambiente.
Se agora deve+ ou h-, respectivamente. O cátion h+ É o íon hidrogênio, também chamado de próton; e h- É o ânion hidreto, o mais "simples" de todos os ânions conhecidos.
[TOC]
Treinamento de um ânion
A formação de um ânion pode ser facilmente explicada dentro da teoria; Embora, experimentalmente, possa se tornar um desafio, especialmente se você quiser puro, sem cobranças positivas atraídas por suas cobranças negativas.
Cargas formais e menos links
Um ânion será formado quando houver um excesso ou ganho de elétrons em um átomo. Esse ganho pode ser determinado usando cargas formais em uma estrutura de Lewis. Além disso, através do método anterior, você pode saber exatamente o que átomo ou grupo deles vem a carga negativa.
Pode atendê -lo: acetonitrila (C2H3N)Quando os átomos formam ligações covalentes, embora a distribuição de elétrons seja eqüitativa, pode haver uma perda parcial de elétrons. Nesse sentido, menos links formam os pares mais eletronegativos e livres de elétrons que eles terão e, portanto, exibem cargas negativas.
Considere, por exemplo, a molécula de amônia, NH3. O NH3 É neutro e, portanto, não tem cargas elétricas. Se um h fosse removido, ou seja, um link n-h foi quebrado, o ânion NH seria obtido2-. Desenhando sua estrutura de Lewis e calculando a carga formal do n, você pode verificar isso.
Após a ruptura de mais links N-H, agora você tem o ânion NH2-; e eliminando o último h, o ânion n é finalmente obtido3-, chamado aniion nitruro. O nitrogênio não tem mais como ganhar mais elétrons, e sua carga -3 é a mais negativa que pode alcançar; Seus orbitais não dão mais.
Reduções
Um ânion pode formar um produto de uma redução: ganha elétrons oxidando para outra espécie, o que os perde. Oxigênio, por exemplo, representa esse tipo de reação química muito bem.
Quando o oxigênio é reduzido, oxidado para outra espécie e se torna ânion de óxido, ou2-; presente em inúmeros minerais e compostos inorgânicos.
Físico
Um átomo pode ganhar elétrons se estiver em uma fase gasosa:
X (g) + e- => X-(g)
Essa maneira de formar um ânion implica um amplo conhecimento de técnicas físicas, enquanto os ânions gasosos não são fáceis de estudar, nem todas as espécies são volatilizadas ou atomizadas com simplicidade na fase gasosa.
Caracteristicas
Em termos gerais, as características típicas de um ânion serão mencionadas abaixo antes de abordar seus tipos e exemplos:
-É mais volumoso do que o átomo neutro do qual.
Pode servir a você: dióxido de cloro (CLO2): estrutura, uso, obtenção, riscos, propriedades-Pode ser mais ou menos estável, apesar da crescente repulsão eletrônica entre seus próprios elétrons.
-Se o ânion vier de um pouco de átomo eletronegativo, como carbono, é muito reativo.
-Defina momentos dipolares fortes.
-Aumenta ainda mais sua interação com solventes polares.
-O ânion monoatômico é isoletrônico ao gás nobre de seu período; isto é, ele tem em sua camada de valência o mesmo número de elétrons.
-Ele pode polarizar a nuvem eletrônica de um átomo de vizinho, repete seus elétrons externos.
Pessoal
Monoatômico
Como o nome indica, é um ânion que consiste em um único átomo: a carga negativa está bem localizada. Cada grupo na tabela periódica possui cargas negativas características; E porque são ânions, eles são os não -metais localizados no bloco P. Alguns exemplos e seus nomes estão abaixo:
-Cl-, cloreto.
-Yo-, Eu último.
-F-, fluoreto.
-Br-, brometo.
-QUALQUER2-, óxido.
-S2-, sulfureto.
-ELE2-, Seleniuro.
-Chá2-, Telururo.
-Po2-, Poloniuro.
-N3-, Nitruro.
-P3-, fosfuro.
-Ás3-, Arseniuro.
-Sb3-, Antimoniuro.
-C4-, carboneto.
-Sim4-, Siliciuro.
-B3-, Boruro.
Oxoaniões
Os oxoaniões são caracterizados por ter uma ligação x = o, onde x pode ser qualquer elemento não -metálico (exceto fluoreto) ou um metal (cromo, manganês, etc.). Eles também podem ter um ou mais links X-O simples.
Alguns oxoaniões com seus respectivos nomes são:
-Clo-, Hipoclorito.
-Irmão-, Hipobromito.
-Io-, Hipoyodite.
-Clo2-, Clorito.
-Clo3-, clorato.
-Io3-, Yodato.
-Clo4-, perclorato.
-Po43-, fosfato.
-Co32-, carbonato.
-Cro42-, cromato.
-Cr2QUALQUER72-, Dicromato.
-SW42-, sulfato.
-S2QUALQUER32-, Tiossulfato.
-NÃO3-, nitrato.
-NÃO2-, nitrito.
-Bo33-, borato.
-ASO43-, Arseniato.
-Po33-, fosfito.
-Mne4-, permanganato.
Orgânico
Moléculas orgânicas têm grupos funcionais que podem ser carregados eletricamente. Como? Por formação ou ruptura de ligações covalentes, muito semelhante ao exemplo da molécula NH3.
Pode atendê -lo: ferro (elemento): características, estrutura química, usosAlguns ânions orgânicos são:
-CH3COO-, acetato.
-Hcoo-, Formatar.
-C2QUALQUER42-, Oxalato.
-Rcoo-, Carboxilato.
-CH3CONH-, Amidato.
-Ro-, Alcoxido.
-R3C-, Carbanion.
-CH3QUALQUER-, Metóxido.
Poliatômico
Oxoaniões também são ânions poliatômicos, ou seja, consistem em mais de um átomo. O mesmo vale para ânions orgânicos. No entanto, o poliiatômico não entra em nenhuma das classificações anteriores. Alguns deles são:
-Cn-, Cianeto (tem um link triplo, Ceg).
-OCN-, Ciano.
-Scn-, Tiocianato.
-NH2-, Amiduro.
-Oh-, hidroxila, hidróxido ou oxidrillo.
-QUALQUER2-, superóxido.
-QUALQUER22-, peróxido.
Molecular ou complexo
Nos ânions orgânicos, alguns grupos funcionais carregados negativamente foram mencionados. Esses grupos podem fazer parte de uma molécula grande e, portanto, o ânion pode ser um composto robusto e muitos links. O mais simples desse tipo de ânions é a hipotética molécula H2-.
Entre outro exemplo desses ânions estão polissulfuros, Sn2-, que consistem em cadeias com vários links S-S. Da mesma forma, os compostos de coordenação de metal com carga negativa podem ser contados, como [cocl4(NH3)2]- e [CUCL4]2-.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Wikipedia. (2019). Ânion. Recuperado de: é.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (21 de março de 2019). Tabela de ânions comuns e lista de fórmulas. Recuperado de: pensamento.com
- Fundação CK-12. (29 de junho de 2016). Formação de ânions. Química Librettexts. Recuperado de: química.Librettexts.org
- Francis e. (2002). Ânions. Faculdade Comunitária Clackamas. Recuperado de: DL.Clackamas.Edu
- Sociedade Física Americana. (3 de novembro de 2011). Sinopse: o ânion molecular mais simples. Recuperado de: física.APS.org
- « Fernando del Paso Biografia, estilo, obras e frases
- Estrutura de anisol, propriedades, nomenclatura, riscos e usos »

