Aminas

- 3526
- 723
- Pete Wuckert
Quais são as aminas?
As aminas São compostos orgânicos derivados de amônia. Neles existem sindicatos covalentes entre carbono e nitrogênio. Naturalmente, a molécula de nitrogênio é cineticamente inerte; Mas graças à fixação biológica, torna -se amônia, que por sua vez sofre reações subsequentes de alquilação.
Quando a amônia é "alugada", substitui um, dois ou três de seus três hidrogênios com átomos de carbono. Esses carbonos podem muito bem vir de um grupo de aluguel (R) ou Aryl (AR). Assim, existem aminas alifáticas (lineares ou ramificadas) e aromáticas.
As aminas são bases orgânicas mais fortes do que a mesma amônia. Eles são facilmente removíveis da matéria vegetal e geralmente têm fortes interações com a matriz neuronal de organismos; Portanto, muitos medicamentos e drogas consistem em aminas com estruturas e substituintes complexos.
Estrutura de amina
 Fórmula geral para uma amina. Fonte: Mache, Wikimedia Commons.
Fórmula geral para uma amina. Fonte: Mache, Wikimedia Commons. Embora varia dependendo da natureza de R, o ambiente eletrônico do átomo de nitrogênio é o mesmo para todos eles: tetraédrico. Mas, tendo alguns elétrons não compartilhados no átomo de nitrogênio (··), a geometria molecular se torna piramidal. Isso é assim com amônia e aminas.
Aminas pode ser representada com um tetraedro, bem como como é feito com compostos de carbono. Assim, NH3 e cap4 Eles são desenhados como tetraedra, onde o par (··) está localizado em um dos vértices acima do nitrogênio.
Ambas as moléculas são aquirais; No entanto, eles começam a apresentar a quiralidade enquanto seu h substitui. A amina r2NH é aquiral se os dois r forem diferentes. No entanto, não tem configuração para diferenciar um enantiômero de outro (como acontece com os centros de carbono quiral).
Isso ocorre porque os enantiômeros:
R2N-h | H-NR2
Eles são trocados a uma velocidade que nenhum deles pode isolar; e, portanto, as estruturas das aminas são consideradas aquirais, mesmo quando todos os substituintes no átomo de nitrogênio são diferentes.
Propriedades da amina
Polaridade
As aminas são compostos polares, já que o grupo amino NH2, Para ter um átomo de nitrogênio eletonegativo, ele contribui para o momento dipolar da molécula. Observe que o nitrogênio tem a capacidade de doar ligações de hidrogênio, que geralmente têm altos pontos de ebulição e fusão.
Características físicas
No mundo da química, ao falar sobre uma amina, o ato involuntário de cobrir o nariz surge. Isso ocorre porque, em geral, eles geralmente têm cheiros desagradáveis, alguns dos quais parecem os de peixe podre.
Pode servir você: reação de MaillardAlém disso, as aminas líquidas geralmente têm tons amarelados, que aumentam a desconfiança visual que geram.
Solubilidade em água
As aminas tendem a ser insolúveis na água porque, apesar de poder formar pontes de hidrogênio com o H₂O, seu componente orgânico majoritário é hidrofóbico. Quanto mais volumosos ou longos os grupos R, menor sua solubilidade na água será.
Quando há um ácido no meio, no entanto, a solubilidade é aumentada pela formação do que é conhecido como sais de amina. Neles, o nitrogênio tem uma carga parcial positiva, que atrai eletrosticicamente para a base do ânion ou do conjugado ácido.
Basicidade
Aminas são bases orgânicas mais fortes que a amônia. Quanto maior a densidade eletrônica em torno do átomo de nitrogênio, mais básico será; isto é, os ácidos do meio desprotilam mais rapidamente. Se a amina for muito básica, pode até arrancar o próton dos álcoois.
Tipos (primário, secundário, terciário)
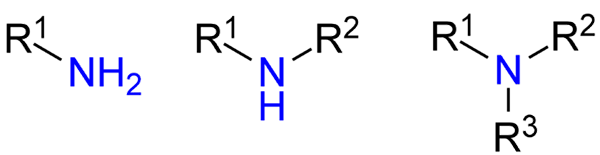 Tipos de aminas. Fonte: Jü via Wikipedia.
Tipos de aminas. Fonte: Jü via Wikipedia. Embora eles não tenham sido formalmente apresentados, foi feita referência às aminas primárias, secundárias e terciárias (imagem superior, da esquerda para a direita).
Aminas primárias (RNH2) são monossustuidas; O secundário (r2NH), são dissolvidos, com dois grupos rcomile ou aril de r; e o terciário (r3N), são trissustuid e carecem de hidrogênio.
Todas as aminas existentes são derivadas desses três tipos; portanto, sua diversidade e interações com a matriz biológica e neuronal são enormes.
Em geral, pode -se esperar que as aminas terciárias sejam as mais básicas; No entanto, essa afirmação não pode ser feita sem conhecer as estruturas de r.
Formação de aminas
Alquilação de amônia
A princípio, foi mencionado que as aminas derivam da amônia; Portanto, a maneira mais simples de formá -los é através de sua alquilação. Para fazer isso, um excesso de amônia é reagido com um halogeneto de alquil, seguido pela adição de uma base para neutralizar o sal de amina:
NH3 + Rx => rnh3+X- => Rnh2
Observe que essas etapas levam a uma amina primária. As aminas secundárias e até terciárias também podem ser formadas; portanto, o desempenho para um único produto diminui.
Alguns métodos de treinamento, como a síntese de Gabriel, permitem obter aminas primárias para que outros produtos indesejáveis não sejam formados.
Pode servir a você: álcool etílico: estrutura, propriedades, usos, obtençãoDa mesma forma, cetonas e aldeídos podem ser reduzidos na presença de amônia e aminas primárias, para dar origem a aminas secundárias e terciárias.
Hidrogenação catalítica
Os compostos nitro podem ser reduzidos na presença de hidrogênio e um catalisador para se transformar em suas aminas correspondentes.
Arno2 => Rnah2
Os nitrilos, rc bl e os amidas, rconr2, Eles também são reduzidos para dar aminas primárias e terciárias, respectivamente.
Nomenclatura
Como as aminas são nomeadas? Na maioria das vezes eles são nomeados de acordo com R, o grupo Aquilo ou Aryl. Para o nome de r, derivado de seu alcano, a palavra 'amina' é adicionada a ele no final.
Assim, cap3CH2CH2NH2 É propilamina. Por outro lado, pode ser nomeado apenas o Alkane e não como um grupo R: propanamina.
A primeira maneira de nomeá -los é tão conhecida e usada.
Quando há dois grupos NH2, O Alkane é nomeado e as posições dos grupos amino são listadas. Assim, h2NCH2CH2CH2CH2NH2 É chamado: 1.4-butanodiamina.
Se houver grupos oxigenados, como OH, a prioridade deve ser dada a NH2, que se torna nomeado como substituinte. Por exemplo, hoch2CH2CH2NH2 é chamado: 3-aminopropanol.
E com relação às aminas secundárias e terciárias, as n letras são feitas para indicar os grupos R. A cadeia mais longa manterá o nome do composto. Assim, Cho3NHCH2CH3 É chamado: n-metiletilamina.
Usos de aminas
Corantes
As aminas aromáticas primárias podem servir como material de partida para a síntese de corantes azo. Inicialmente, as aminas reagem para formar sais de diazônio, que formam os compostos por cópula de telhado (ou acoplamento diazóico).
Devido ao intenso de sua coloração, eles são usados na indústria têxtil como material de tingimento; Por exemplo: Metil Orange, Brown 138 Direct, Sunset Yellow FCF e Ponceau.
Drogas e drogas
Muitos medicamentos agem com agonistas e antagonistas de neurotransmissores de amina natural. Exemplos:
-A clorofeniramina é um anti -histamínico usado no controle de processos alérgicos devido à ingestão de alguns alimentos, febre do feno, picada de insetos, etc.
-A clorpromazina é um agente sedativo, não o indutor de sono. Alivia a ansiedade e é até usada no tratamento de alguns transtornos mentais.
-Efedrina e feninfedrina são usadas como descongestionantes do trato respiratório.
Pode atendê -lo: osmolaridade-Amitriptritalina e imipramina são aminas terciárias que são usadas no tratamento da depressão. Cone antidepressivo tricíclico é classificado por sua estrutura.
-Analgésicos opióides, como morfina, codinha e heroína, são aminas terciárias.
Tratamento de gás
Várias aminas, incluindo diglicolamina (DGA) e dietolamina (DEA), são usadas na eliminação de gases de dióxido de carbono (CO2) e sulfeto de hidrogênio (H2S) Presente em gás natural e refinarias.
Química Agrícola
Metilaminas são compostos intermediários na síntese de produtos químicos utilizados na agricultura, como herbicidas, fungicidas, inseticidas e biocidas.
Resinas Manufatura
Metilaminas são usadas durante a elaboração de resinas de troca iônica, utilizáveis na desionização da água.
Nutrientes animais
A trimetilamina (TMA) é usada principalmente na produção de cloreto de cloreto, um suplemento de vitamina B usado em galinhas, perus e porcos.
Indústria de borracha
O óleo de dimetilamina (DMA) é um emulsificante para uso na produção de borracha sintética. O DMA é usado diretamente como modificador de polimerização na fase de vapor do butadieno e como um estabilizador do látex de borracha natural em vez da amônia
Solventes
Dimetilamina (DMA) e monometilamina (MMA) são usados para sintetizar solventes polares polares de timetilformamida (DMF), dimetilacetamida (DMAC) e N-metilpirrolidona (NMP) (NMP).
Entre as aplicações DMF, inclua: revestimento de uretano, solvente de fio acrílico, solventes de reação e solventes de extração.
O DMAC é usado na fabricação de corantes e solventes de fios. Finalmente, o NMP é usado no refinamento de óleos de lubrificante, coleta e revestimento de esmalte.
Exemplos de aminas
Cocaína
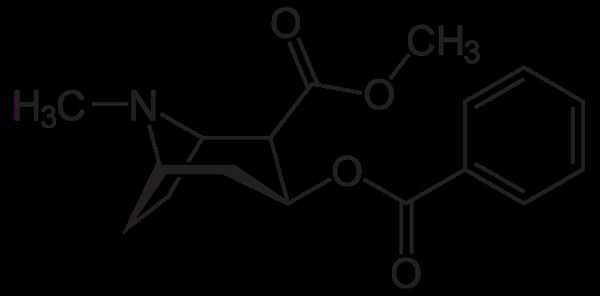 Molécula de cocaína. Neurotokeker, Wikimedia Commons
Molécula de cocaína. Neurotokeker, Wikimedia Commons A cocaína é usada como anestésico local em certos tipos de cirurgia ocular, orelhas e garganta. Como visto, é uma amina terciária.
Nicotina
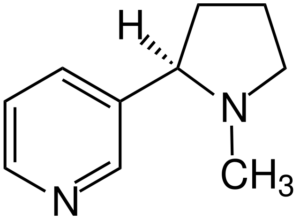 Molécula de nicotina. Fonte: Jü [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons
Molécula de nicotina. Fonte: Jü [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons A nicotina é o principal agente do dependência do tabaco e quimicamente uma amina terciária. A nicotina presente na fumaça do tabaco é absorvida rapidamente e é altamente tóxica.
Morfina
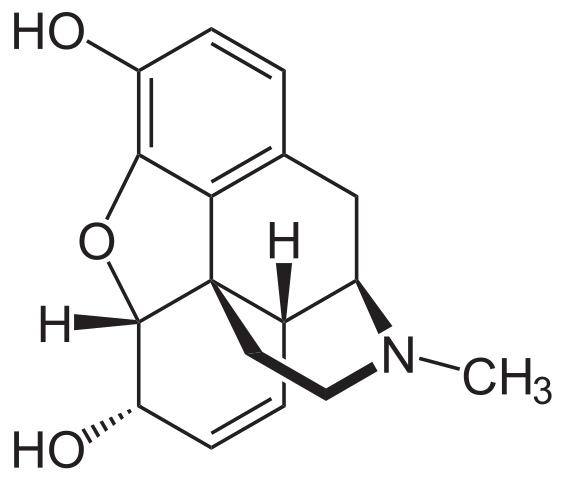 Molécula de morfina. Fonte: Neurotoger [Domínio Público], da Wikimedia Commons
Molécula de morfina. Fonte: Neurotoger [Domínio Público], da Wikimedia Commons É um dos analgésicos mais eficazes para aliviar a dor, especialmente o câncer. É, novamente, uma amina terciária.
Serotonina
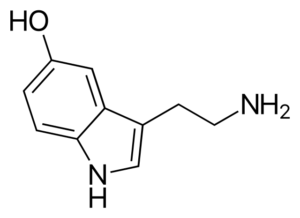 Molécula de serotonina. Fonte: Harbin [Domínio Público], da Wikimedia Commons
Molécula de serotonina. Fonte: Harbin [Domínio Público], da Wikimedia Commons Serotonina é um neurotransmissor de amina. Em pacientes deprimidos, a concentração do metabólito principal da serotonina diminui. Ao contrário das outras aminas, isso é primário.
Referências
- Metilaminas: usos e aplicações. Recuperado de: Chemours.com
- Pesquisa de mercado de transparência. (s.F.). Aminas: fatos e usos importantes. Recuperado de: transparencymarketresearch.com

